�u���O�@���w�ƊE�̘b��@ knak�̃f�[�^�x�[�X����
�@�@�@ �@�@�ڎ�
����͉��L�̃u���O�������Ƃɂ܂Ƃ߂����̂ł��B
�ŐV���� �@ https://blog.knak.jp
2019/12/16 �Ē��f�Ջ��c�A��1�i�K�ō��Ӂ@
�Ē������{��12��13���A�f�Ջ��c�́u��1�i�K�v�Ő������ӂ����Ɣ��\�����B
�č��͑Β����يł̐V�K�����𒆎~���A�����ς݂̊ł��ꕔ�ɘa����B�Đ��{�ɂ��ƁA�����͕č�����N��500���h���K�͂̔_�Y�i�w��������B
����͌����ł̍��ӂŁA���ꂩ�當�������ď�������B�o���̔��\�ɂ͈�v���Ă��Ȃ�����������A������]���������ď��߂Ĉ��S�ł���B
�t�L
�g�����v�哝�̂�12��31���A������������1��15���Ƀz���C�g�n�E�X�ɏ����A�����ɍ��ӕ����ɏ�������ƃc�C�b�^�[�ŕ\�������B
�[�[�[
Trump�哝�̂�5��5���A�����̒m�I���Y���N�Q�Ȃǂ𗝗R��2000���h�����̓������i�ɉۂ��ł��A5��10�����猻�݂�10%����25%�Ɉ����グ��ƕ\�������B
�哝�̂�5��8���A�t�����_�B�ŊJ���ꂽ�x���ҏW��ŁA�u��������j�����B����Ȃ��Ƃ͋����Ȃ��B�����璆���͑㏞�����ƂɂȂ�v�Əq�ׂ��B
�ău���[���o�[�O�ʐM�ɂ��ƁA�k���ł̊t�����c�Œ��������A�O����Ƃɑ���Z�p�ړ]���v������@���������ۂ����B���C�g�n�C�U�[�����炻�̕����哝�̂��{��A�lj��ł��ۂ��Β����ق̋��������߂��Ƃ����B
�������͕����ɏ������ď��߂Đ������ӂł���Ƃ����B
2019/5/14�@�Ē��ʏ����c��3�̑���_
�[�[�[
White House�́gHistoric Phase One Trade
Agreement�h�ō��ӂ����ƌւ����B
�����́A�m���A�Z�p�ړ]�A�_�ƁA���Z�T�[�r�X�A�ʉ݁A�בփ��[�g�̕���ł̍\�����v�ɓ��ӂ����B
���ӂ̈ꕔ�Ƃ��āA�č���Section
301�ł̒lj��ł�傫���C�����邱�Ƃɍ��ӂ����B
����Phase 1 ���́A�č��̑Β��f�Ղ̃o�����X�Ɍ����d�v�Ȉ���ƂȂ�B
USTR�����l�̔��\���������A�������i�ɑ��鐧�يłɂ��Ă͈ȉ��̒ʂ�B
�č���Section 301 �����Ő��يł��ۂ����B
�i12��15�������\��� ����� 1600���h��
�ɑ���15%�̐��يł͉����ƕ��邪�AUSTR�͂���ɐG��Ă��Ȃ��B�j
USTR��
Fact Sheet �\�����B
�Z�p�ړ]
�����͊O����Ƃ̒����i�o��{���F�̎擾���̌��Ԃ�ɋZ�p�ړ]�����߂�i�N�̊��s���~�߂邱�Ƃɓ��ӁB
�_��
�f�Ղ̍\���I��ǂ���菜���A�č��̐H�i�A�_�Ɛ��i�E�C�Y���̗A�o�̑啝�g����T�|�[�g
���Z�T�[�r�X
���L�����Z�T�[�r�X�Ǝ҂ɑ���i�N�̖f�ՁE�����o���A����菜���B
�ʉ�
�ʉݐ艺����בփ��[�g�̖ڕW�ݒ����߂�B�������A�������J�j�Y���𐄐i�B
�f�Պg��
������2�N�Ԃ�2000���h���ȏ�̍��E�T�[�r�X�̗A���i2017�N��Łj
��������
���ӈᔽ�Ȃ�K�v�ȑ[�u�����B�i�ł͊ōĔ����j
�������{������13���A��1�i�K�̖f�Ջ���\�����B
���ӂ́A �u�����A�m�I���Y���A�Z�p�ړ]�A�H���Ɣ_�Y���A���Z�T�[�r�X�A�בփ��[�g�Ɠ������A�f�Պg��A�ԕ]���ƕ��������A�ŏI������9�́v���܂܂��B
�\�Ȍ��葁���ɖ@�I�ȃ��r���[��|��Z���Ȃǂ̕K�v�Ȏ葱�����������A�_��̐����ȏ����Ɋւ����̓I�Ȏ�茈�߂�������B
�č����������i�ɑ���ł̕��ۂ�i�K�I�ɔp�~����B
�����͕č��̔_�Y���̗A����啝�ɑ��₵�A�_�Y���̍��������̃M���b�v�߂邱�Ƃ��ł���B�č��́A�����ō��ꂽ�u�������ꂽ�Ƌׂ���уi�}�Y���i�v�A����ї��̊��k�ނƐV�N�ȃi�c�����V��č��ɗA�o���邱�Ƃɓ��ӂ����B
�m�I���Y���Ɋւ��āA��Ɣ閧�A�Ɋ֘A����m�I���Y���̕ی�A�����̗L�����̉����A�n���I�\���A���쌠�N�Q�̎����܂�A�d�q������v���b�g�t�H�[���̋U���ȂǁA�������̕���ō��ӂɒB�����B���쌠�N�Q����ыU�����i�̐��Y�ƗA�o�������܂�A���W�̈��ӂ̂���o�^�������܂�A�m�I���Y���̎i�@���s�Ǝ葱������������B
�[�[�[
�ł́A���يłł̍��ӂ͈ȉ��̒ʂ�B
�č� 2500���h������25���̊ł��ێ��i������30����Ɂj
����
12/15���{�\���5%&10%�lj��ł������i�����Ԋ� 25%+10% �������j
�č��̑Β����يŁF
�@
���� 8/23 ���\ 10/11 12/13
�@�`�B
�@ 340���h���@
2018/7/6 �@25% 2019/10/1�@30%�\��
�����グ�����@
25%�����u��
�A 160���h��
2018/8/23 �@25%
�B 2000���h�� 2018/9/24 �@ 10%
��2019/5/10 25%
�C 3000���h��
��ʁ@�@1200���h�� 2019/9/1�@�@10% 9/1�@ 15%
��
7.5%�Ɉ�������
������@ 1600���h�� 2019/12/15 10% 12/15 15% �\�� ��
����������
�����̑ΕĕŁF�� ������
�@
�@
����
8/1���\
12/13
�@�{�A�@
�@340���h��
2018/7/6 25%
5078�̐ŖځA��750���h�� �@2019/9/1�@�v1717�i��
�@2019/12/5�@�v3361�i���\��
�Ȃ��A9/11�ɏ��O�i�ڔ��\
�@�A�B�@ 9/11���O�i�ڏ����A �����u�� 9/1���{�������u��
�A160���h��
2018/8/23 25%
�B600���h��
A
2018/9/24 5% �������i
B
2018/9/24 10%
B�̈ꕔ
2019/6/1�� 20%
B�̈ꕔ
�@�@�@ �� 25%
�����̏�p�ԊŁF
�@
�S�� �Εč�
���� 25% 25%
2018�N5�� 15% 15%
2018�N7���@�ΕĒlj��� 25% 40%
2019�N1���`3�� �ΕĒlj��ŖƏ� 15%
2019�N4��1�����lj��ł��ꎞ��~
15%
2019�N12��15���ȍ~ �����{�lj�10%�\�� 50%
2019/12/13�@�@��~
15%
����܂ł̌o�܁F
2019/12/17�@������̕�Merck�ƕ�Sanofi�A�����Ö[�J�[���@
�@
��Merck�ƕ�Sanofi��12��9���A�ʁX�ɁA���Ö����|���铯�Ƃ̔����\�����B
��Merck (�h�C�c��Merck�Ƌ敪���邽�߁A�ĉ��ȊO�ł̎Ж��� MSD
�j�͒����̕č���ArQule ��27���h���ŁASanofi�͕Ă̐V�����[�J�[ Synthorx��25���h���Ŕ�������B
�O�҂͎������z��1.32�{�A��҂�2.82�{�ƁA�啝�ȃv���~�A�������������ł���B�����s��ƂȂ��Ă���B
�@
1) Merck / ArQule
ArQule �� ����̊��Ɣ��ᇊw�I����Ɋ֗^���鐶���w�I�o�H�ɏœ_�āA���Ö@�̌����E�J�����s���o�C�I���i��Ђł���B
�Տ��i�K�̃p�C�v���C���́A�W�I�Ƃ���銳�ҏW�c�ɑ������4�̌��琬�藧�B
�uARQ 531�v�͖쐶�^�����C481S�ψٌ^�̃u���g���^�`���V���L�i�[�[(BTK)�̋��͊��t�I�ȓ�d�j�Q�܂ł���B �v�����}���`�L�i�[�[�j�Q�܂ł���B
Merck�͓��ɁuARQ 531�v���d�����Ă���B
ARQ197�́A�̍זE���B���qHGF�̎�e�̂ł���c-Met��I��I�ɑj�Q����V�K�@���̒ᕪ�q�������B
���O����2015�N12���̕ŁAArQule�Ƃ̒�g�ɂ��̍זE�����Ö�`�o���`�j�u�iARQ197�j�Ɋ��҂������Ă��邪�A 2017�N2���ɁA��3���Տ������ɂ����āA�S�������Ԃ̉�����B�����邱�Ƃ��ł��Ȃ������Ɣ��\�����B
�@
2)�@Sanofi / Synthorx
���R�E�̂��ׂĂ̐����̈�`�q���́AA�AG�AC�AT��4��ނ̕����ŕ\�킳��邪�AFloyd
Romesberg
���m�́A�u�n����̑��l�Ȑ����͂�����2�̉���AA-T��C-G����Ȃ�DNA�ŃR�[�h����Ă���B����ꂪ�쐬�����̂́A����2�ɉ����đ�3�̐l�H�̉�������肵�đg�ݍ��܂ꂽ�������v�Əq�ׂ��B
Synthorx �̃v���W�F�N�g��1�ł́A�R����܁u�C���^�[���C�L��-2�v�̐V�����o�[�W�����iTHOR-707�j����邱�Ƃ�ڎw���Ă���B�C���^�[���C�L��-2�͕����̖��ȕ���p�����A�������̃o�N�e���A�����ƂȂ�|�C���g�ɂ����ĕ��ʂŖ��������ɓ��ꊷ���邱�ƂŁA���������ł��邩������Ȃ��Ƃ����B
Sanofi�͂����傫���]�����Ă���A����Ɠ��Ђ̐��i�Ƃ̃R���r�l�[�V���������҂��Ă���B
�[�[�[
Sanofi�͔����������m�ۂ��邽�߁A��g����̕�Regeneron
Pharmaceuticals �̊����p����\�������邱�Ƃ𖾂炩�ɂ����B
Sanofi�͂܂��A���F�a�������A�������d���ǁA�����ȂǂU�̗L�]�Ȏ��Õ���ɏƏ����߁A���A�a�ƐS�������̌�������߁A���Y�������߂邱�Ƃ�2022�N�܂ł�20�����[���̐ߌ��������ނ��Ƃ𖾂炩�ɂ����B
�u����I�ȃC�m�x�[�V������������Ȃ����A���������߂ă`�����X�̂��镪��Ɍo�c�����𓊓�����K�v�����邱�Ƃ�F�����Ă���v�Ƃ��Ă���B
�@
2019/12/18�@HOYA�A���Ŏq��ЂɓG�ΓITOB�@
HOYA��12��13���A���Ŏq��Ђ� �����̐������u���[�J�[�� �j���[�t���A�e�N�m���W�[��TOB�����{����Ɣ��\�����B 1�� 12,900 �~�ł�TOB�ŁA �ő�1477���~�𓊂��đS���̎擾��ڎw���B
TOB�̔��t�\�萔�̉����� 7,634,000 ���i 66.67 ���j �Ɛݒ肵�Ă���A ���Ńf �o�C�X���X�g���[�W�����傷�邱�Ƃ��K�v�����ƂȂ�B
�j���[�t���A�e�N�m���W�[�̑劔��͎��̒ʂ�B(2019/9/30)
���Ńf�o�C�X���X�g���[�W 52.35% ���Ŏq���
���ŋ@�B 15.78% ���ł����p�A�O���[�v����O���B2020/4�ɎʼnY�@�B�ɉ���
�@
����A�e��Ђ̓��ł�12��13���A���q���4�Ђ̂����A POS���W���E��� �̓��Ńe�b�N������3�ЁA���d�ݔ������Ńv�����g�V�X�e�� �A�D����Y�ƌ����̓d�@�V�X�e������|�������œd�@ �ƁA �j���[�t���A�e�N�m���W�[
�ɑ�TOB�����{����Ɣ��\�����B���z�͖�2000���~�B���S�q��Љ����邱�ƂŁA��������Ƃ̗��v�����̉\����������A�o�c�����̑��݊��p��ӎv����̐v�����ɂȂ���B
�t�L
���Ńv�����g�V�X�e���Ɛ��œd�@�ɑ���TOB�͐��������B �͎�����95.28%�A���œd�@��92.68%�ƂȂ邪�A ����A�c�銔�����擾���Ċ��S�q��Љ�����B
�Ȃ��A���ł�12��23���A�j���[�t���A�e�N�m���W�[��TOB��2020�N1��16���܂ʼn�������Ɣ��\�����B����ɗ��Ђ̒�Ă̌������Ԃ�݂��邽�߁A�j���[�t���A�����ł�TOB���Ԃ̉�����v�������B
���ŋ@�B��1��15���A���łɂ��j���[�t���A�e�N�m���W�[��TOB�ɉ��傷��Ɣ��\�����B
���ł�HOYA�̒�Ăɉ����Ȃ��ƌ��߂Ă���AHOYA��TOB����������\���͂Ȃ��Ȃ����B���̂��߁A���ŋ@�B�͓��łɂ��TOB�iHOYA�̒��i�������j�ɉ��債�Ă��A���傩��i�ׂ��N������鋰�ꂪ�Ȃ��Ȃ����Ɣ��f�����͗l�B
�t�L
���ł�1��17���A�j���[�t���A�e�N�m���W�[�ɑ���TOB�����������Ɣ��\�����B
�@
���ł̓j���[�t���A����|���鐻�����u�̊���i�����Ă���A���S�q��Љ����邱�ƂŌ����J�����@���I�ɂł���Ɣ��f�����B
����ɑ��AHOYA��1,000�~����12,900�~�ł�TOB�ŁA���Łi ���Ńf�o�C�X���X�g���[�W�j�ɂ��TOB���������Ă��Ȃ����Ƃ������ɂ����B
2020�N4����TOB�J�n��ڎw���B
���ő��͂���ɉ����Ȃ��\���ŁA�G�ΓI�ȑ��D��ɔ��W����\��������B
���ł�TOB�̐��������Ƃ���14.27���������ɐݒ肵�Ă���i����ŕۗL����2/3���邱�ƂƂȂ�j�B
���ŋ@�B��1938�N�ɎʼnY���쏊�i���Łj���o���E�ݗ������V�܂̃O���[�v��Ƃ������B
���ł�2017�N3��2���A20%�����o�����铌�ŋ@�B�̊����p����Ɣ��\�����B�����A���q�͔��d���Ƃ̋��z�����ŗh�炢�������̗��Ē����̂��߁A���Ƃ�ۗL���̔��p���}���ł����B
3��3���̎���J�n�O�ɓ��ŋ@�B�������،�������̗���O�����ʂ��Ď��Њ����������{���A���ŏ��L�������B
2020�N4������́A�Ж�����u���Łv���O���A�ʼnY�@�B�ɉ��̂���B���Ђ̃u�����h�́u SHIBAURA�v�ł��� �B
���݂̓��ŋ@�B�̕M������́A���㐢�����������㗦����t�@���h�̃I�t�B�X�T�|�[�g�ŁA���Ђ�5.93%�A�����ۗL�����܂�9.19����ۗL����B
���㎁�́u���ŋ@�B�́A���̂܂ܓ��ł�TOB�ɉ�����Ȃ�Ă��Ƃ͂��Ȃ��͂����v�ƃR�����g�����B
�،���Њ������u���̂܂ܓ��ŋ@�B�����i���Ⴂ���̓��ł�TOB�ɉ�������A���ŋ@�B���g�������\�i�ׂ��N������郊�X�N������v�Ǝw�E����B
����A���ł�������艿�i�������グ�AHOYA�Ƃ̊Ԃő��D��ƂȂ�\��������B
�t�ɁA���ł��H���ύX����\�����\����Ă���B�j���[�t���A�����S�q��Љ�����Ɩ�650���~�̏o��ƂȂ�̂ɑ��AHOYA��TOB�ɉ������700���~�ȏ�̌�������ɓ���
���ƂɂȂ�B
�[�[�[
�j���[�t���A�e�N�m���W�[��2002�N�ɓ��ŋ@�B���甼���̑��u���Ƃ��p�����đn�Ƃ����B
�����̃f�o�C�X�̐��\�Ɛ��Y������̌���ł�������̗v�ƂȂ�t�H�g�}�X�N
�ɍ����x�ȉ�H�p�^�[�����`�������d�q�r�[���}�X�N�`�摕�u �Ɋւ���30�N�ȏ�̊J���̗��j�����B�}�X�N�������u ���J�����A����ɁA����d�C�����ԂȂǗp�r�̊g�傪���҂����
�p���[�����̌������G�s�^�L�V�����������u ���J��������p���̒i�K�ɓ����Ă���B
HOYA�͔����̃E�G�n�[�ɉ�H��`�����łƂȂ�u�u�����N�X�v�ƌĂԃK���X���i��7���ȏ�̃V�F�A������ق��A���̕\�ʂɔ��ׂȉ�H���`�������u�t�H�g�}�X�N�v�����Ă���B
��H��`�悷�鑕�u����|����j���[�t���A����荞�ނ��ƂŔ����̊֘A�̎��Ƃ������������l��
�ŁA2017�N�ȍ~�A�j���[�t���A�ɑ��ĕ�����A��g��Őf���Ă����Ƃ����B
�@
2019/12/19�@�W���p���f�B�X�v���C�A �������A�Z�b�g�O���[�v ����̎������B�Ɋւ����{���ӏ�����
�@
�W���p���f�B�X�v���C�iJDI�j��12��12���A �Ɨ��n�����ږ���������A�Z�b�g�O���[�v ����̎������B�Ɋւ����{���ӏ�
����������Ɣ��\�����B
�������A�Z�b�g�́A ���{�J����s�q������������K���E�X�^�����[�،��̊��������{�����߂�Scott
Callon ����2006�N5���ɐݗ����� �B
�Ж��� �u�������v�͐痘�x�����������l�̐S�\���u������v����̂����B�o�c���O�́A
�u���{�𐢊E��L���ɁB���̖����S��s����������́w�������x�v�ł���B
Callon
�В��̓����X�^���X�͒����ۗL�������Ƃ����B
�[�[�[
JDI�� Suwa
Investment Holdings �Ƃ̊Ԃ�800���~�̓�������_���������Ă��邪�ASuwa
Investment �o���҂����X���E���Ă���A�c��o���҂ƌ����p�����Ă��邪�A�ړr�������Ă��Ȃ��B
�@
�@
������
2019/6/17 JDI ���\
6/27�@���\ 7/12���\ 9/26���\
��
��p
TPK Holding
�����W�c �j
230�S���h��
���E�ʒm���
�[
�[
�[
�[
Cosgrove Global
130�S���h��
�@����̒ʒm����� ���E�ʒm
�[
�[
�[
�[
����
Harvest Tech Investment
Managemen t �Î�����Ǘ��j
190�S���h��
200�S���h���ɑ�
200�S���h��
���� 200�S���h��Apple 100�S���h��
��
���E�ʒm
(CB-2)�@�@ �@�@�@�@200���~
�@����B
200���~
�@
200���~
��
�@
�s���̏ꍇ�A�X�ɏo��
200�S���h��
����
+100�S���h��
���`
Oasis Management
�[
���E���150�S���h���@
150�S���h��
150 �` 180 �S���ăh�� 161 �` �� 193 ���~�j
��
800���~�Ƃ�
����
���v
800���~
�@
800���~
683���~�`715���~
800���~
�H
����A ���� Suwa �����
�o���� 2019 �N 12 �� 31 ���܂łɎ��{����Ȃ������� ���ɁA�������g���X�g���� 800 ���~���� 900 ���~�̎������B �����{����|�̍ŏI�_��̒��� �Ɍ����ċ��c��i�߂邱�Ƃ����� �����B ��̓I�ȓ��e�y�я����ɂ�
���ẮA���㗼�Ћ� �c�̏㌈�肷��
�B
�t�L�@ Suwa ����̏o��
�� 2019 �N 12 �� 31 ���܂łɎ��{����Ȃ������BJDI�͂������g���X�g�Ƃ̋��c��i�߂�B
�@
JDI�͂���ɉ����A���L�̌������Ă��邱�Ƃ𖾂炩�ɂ����B
1)�@���v�Ƃ�Apple
�@Apple��Suwa�̒��������Ƃ�ʂ���100�S���h���̏o����\�肵�Ă����B
�@12��12���ɁA�������A�Z�b�g����400���~�ȏ�̎������B�������ɁA���L�̓_�ŋ��c���邱�Ƃō��ӂ����B
�@�E����̎x���������̊ɘa
2)�@�ʂ̎����
�@�������A�Z�b�g����̎������B�������ɁA���L�̓_�ŋ��c���邱�Ƃō��ӂ����B
�@�E JDI�ɑ��鎑�������AJDI���L���Y�̎擾�y�юx�������̉��������� �߂����Ɩʋy�э����ʂɂ����� ���z�� 50 �S���h���� �x�� �ԍڕ���y�уf�B�X �v���C����ł̐헪�I��g�A�y�уT�v���C�`�F�[���}�l�W�����g�ɂ����鋦��
�[�[�[
JDI�ɂ��ẮA���L�̖�肪����B
1)�@JDI��11��21���A�o���S���̒j���������s���o�����J��Ԃ��A��Ђ̎�����5��7800���~�𒅕����Ă����Ɣ��\�����B
�@�@JDI�͂��̊�����2018�N12���ɒ������ق���ƂƂ��ɁA�Y�����i���Ă��邪�A���̔��\��Ɏ��E�����ƕ���Ă���B
2)�@���̊�����11��26���ɁAJDI�̉ߔN�x���Z�ŕs�K�ȉ�v�������s���Ă������ƁA���ꂪ�����̌o�c�w����̎w���ōs�������Ƃ���Ђɓ`�����B
�@ JDI�͍�����ʈψ���Ŏ����W�̒�����i�߂�Ƃ��Ă���B
3)�@������
�@ 2019�N9�����̒��Ԍ��Z�� 101,612�S���~�̍����߂ƂȂ����B
�P��:���~
�@
���㍂ �c�Ɨ��v �o�험�v ���ʑ��v �������v ����
2017/3
8,844
185
-89
-24
-317
3, 2 7 1
2018/3
7,175
-617
-937
-1,437
-2,472
8 2 0
2019/3
6,367
-310
-442
-625
-1,094
7 0
�@
�@
�@
�@
�@
�@
�@
2018/4-9
2,143
-145
-190
119
-95 �@
2019/4-9
2,378
-356
-438
-637
-1,087
-1, 0 1 6
����
235
-211
-248
-756
-992 �@
���L�̓��ʑ������v�サ���B
���R�H�ꌸ���lj��i�ꎞ��~�֘A�j-514�A ���������ސE��
- 90�A���̑��A���v�@-637�S���~
�Q�l�@2019/4-6���Z�@ 2019/8/14
JDI�������߂�
�{�Ƃ̉t���p�l�����Ƃ��؍��⒆�����[�J�[�Ƃ̌����������ɂ��炳��Ă���B
����܂�Suwa Investment �Ƃ̌��͓�]�O�]�����B ����A���c�J�n�ō��ӂ����i�K�ł���A���ۂɏo�����s����܂ł͈��S�ł��Ȃ��B
2019/12/19�@�ĉ��@�A�g�����v�哝�̂�e�N�i�ǁ@
�ĉ��@��12��18���̖{��c�Ńg�����v�哝�̂̃E�N���C�i�^�f������e�N�i�nj��c�Ă��^�������ʼn������B
�u���͗��p�v�̒e�N�����͎^��230�A����197�ʼn������B
�@
���a�}
����} ������
���v ����}
�^�� 0
229 1
230 �@
����
195
2
�@
197
Peterson�A Van
Drew
present �@
1
�@
1
Gabbard
���� 2 1 �@
3 �@
���v
197
233 1
431 �@
�c����ւ̋��͗v�������ۂ���悤����������Ɏw�������u�c��W�Q�v�̏����͎^��229�A����198�ʼn����ꂽ�B
�@
���a�}
����} ������
���v
����}
�^�� 0 228 1 229 �@
����
195
3
�@
198
Peterson�A
Van Drew�A Golden
present �@
1
�@
1
Gabbard
���� 2 1 �@
3 �@
���v 197 233 1 431 �@
���@���� 435�A���� ���� 4
���a�}�͊�����2���������A�S�����������B
����}����͉��L�c�����^�������B
Collin Peterson�� Jeff
Van Drew��2�l�́A
Jeff Van Drew�� ���̍̌��̌�A�u�}�h�����x�����Ȃ���A�e�N�����͍��Ƃ�����ɕ��f���A�ŏI�I�ɂ͏�@�ŋp������邾�����v�Ǝ咣�����B �������ɖ���}�𗣒E���邩�ǂ����\����Əq�ׂ��B12��13 ���Ƀz���C�g�n�E�X�Ńg�����v�哝�̂Ɩʉ�Ă���B
Collin Peterson�͑哝�͍̂߂�Ƃ��Ă��Ȃ��Əq�ׂ��B
Jared Golden �c���́u���͗��p�v�ł͎^���A�u�c��W�Q�v�ł͔������B
Tulsi Gabbard�c���͗��c�Ăł�������A�u�o�ȁv�ƕԎ����A���������B
�哝�̂��e�N�i�ǂ��ꂽ�͕̂Ďj��3�l�ڂŁA�Љ�̕��f���[�܂铯���ŁA��吭�}�Ԃ̑Η�����i�ƌ������錩�ʂ��B
2020�N1����{�ɂ́A��@�ł̒e�N�ٔ��Ɉڂ邪�A��@�́A�^�}�E���a�}���D���̂��߁A��ƂɎ���\���͒Ⴂ�Ƃ݂��Ă���B
�t�L
��@���a�}�͒Z���ɔی�����\�������A���@�̃y���V�c���͐����������ؐl�Ƃ��ď��v���邱�ƂȂǂ����߁A�Η����Ă���B
2019/12/20 �@�x�m�t�C�����A�����̈�Ë@�펖�Ƃ�
�@
�������쏊 ��12��18���A �摜�f�f�֘A���� �� �x�m�t�C���� �ɏ��n���邱�� �����肵��
�Ɣ��\�����B
�����͊֘A���Ƃ�V�݂̎q���
�x�m�t�B�����w���X�P�A�Ɉڊǂ��A���Ђ̊����ׂĂ�x�m�t�B�����ɏ��n����B
�t�L�@2021�N2���A ��Е����� �葱�����J�n���ꂽ���Ƃ��āA���������\�莞���� 2021 �N 3 �� 31 ���Ƃ��邱�ƂɌ���
�t�L�@ 2021�N3��31���A�����葱�����������A �������쏊������ ���p�̂��߂ɐݗ����� �u�x�m�t�C�����w���X�P�A�v �� �x�m�t�C���� �� 100% �q��ЂƂ��ăX�^�[�g�B
�������镔��̎��Ɠ��e
�́A �摜�f�f�V�X�e�� ( CT �A MRI �A X ���f�f���u�A�����g�f�f���u�� ) �A�d�q�J���e���� ���� �J���E�� ���E�̔� �E�ێ�T�[�r�X
�ŁA���̎��Ƃ�2019�N3�������㍂��
1,432 ���~
�ł������B
���Ђ͎��Ɖ��l�� 1,790 ���~
�Ƃ��邱�� �� ���ӂ��Ă���A�ŏI�I�Ȋ� �����n���z�́A���^�]���{�z
�Ə��L���q���z�Œ������A�m�� ���� �B
������ �A�����Z
�� ���ƍĕғ����v �� 1,110 ���~���v�シ��
�B
�摜 �f�f�֘A ���� �́A ��i���ł͍���▝�������̑����A�V�����ł͌o�ϐ����� ������Ð����̌���Ȃǂ̃j�[�Y���������I�Ȑ����������܂�Ă���
�B �ƊE�ĕ҂̐i�W �� �O���[�o�� ���� �� �����ɂ�� �A���ƋK�� �� �g�傪�܂��܂��d�v �ɂȂ��� ����B
�܂��A�����̏ꍇ�A �@��̒P�Ɣ̔��������A�c�Ɨ��v���͒ᐅ���ɂȂ��Ă���B
�{�N8���̕ł́A�����͉摜�f�f�@�펖�Ƃp������j�ŁA���p��̑I��ɓ����Ă���A�C�O�̓����t�@���h�Ȃǂ������ɊS�������Ă���
�Ƃ��ꂽ�B
����A �⊮���̍� �� �̔��`���l�� �� �摜�����Ȃǂ̗D�ꂽ �Z�p�͂����x�m�t�C������ �Ώێ��Ƃ� ���n ���邱�Ƃ��A����Ȃ鐬���Ƌ����͋����̂��߂ɍœK�ł���Ɣ��f�����B
�@
�t�L�@�@
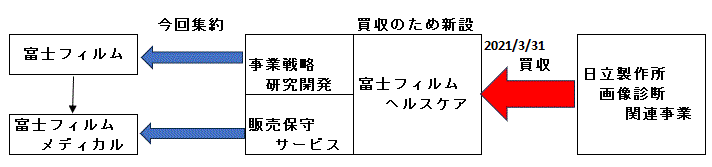
2023/7/18�@���f�B�J���V�X�e�����Ƃ̂���Ȃ�̐������Ɍ����č����O���[�v��Ђ��ĕ�
�[�[�[
���p���鎖�Ƃ́A�����̎q��Ђ��������������f�B�R
����|����MRI�ƃR���s���[�^�[�f�w�B�e���u�iCT�j�A����ɂ��̎q��Г����A���J���f�B�J�������݂������Ă��������g�f�f���u�𒆐S�Ƃ����摜�f�f�@�펖�Ƃł���B
�@�������f�B�R�F
1949�N�ɓ������쏊�Ɩa�D�@�B���[�J�[
6�Ђ̏o���ɂ�蓌���{�@�ۋ@�B�Ƃ��Đݗ��B
�����͖a�D�@�B�̔̔��ɂ������Ă������A�����̊e�탌���g�Q���@�B�������悤�ɂȂ�A1954�N
�ɓ��������g�Q���ɉ��̂����B
�A���J���f�B�J���F
�����g�f�f���u�A���e頏ǐf�f���u�A���ː����葕�u�A�o�C�I�֘A���u�A���̌������u�A�������u�Ȃǂ��肪����B
������2016�N�Ƀw���X�P�A���Ƌ����Ɍ����A�������f�B�R����ѓ����A���J���f�B�J���̐�������ȊO�̕���������
�z�����A��������͓������f�B�R�𑶑���ЂƂ��č������A�����w���X�P�A�E�}�j���t�@�N�`�������O�Ƃ����B
�[�[�[
�������쏊�͋}���ɍ\�����v��i�߂Ă���B
���̂��сA���j�q��Ђł��鉻�w���A���������̔��p������A���a�d�H�ɔ����̗D�������^���邱�Ƃ����߂��B
���a�d�H��12��18���A�����������������J�����t���iTOB�j�ɂ�蔃������Ɣ��\�����B���t����͑��z9640���~�ƂȂ�B
�����͏��L����51.29%�S�Ă����n����B���n���z��4,940���~�B
2019/12/2
�������쏊�A�q��Г������������a�d�H�ɔ��p��
�Η͔��d�V�X�e������
�ł́A�ʋL�̋L���̒ʂ�A �O�H�d�H��
�Ƃ�JV�� �O�H�����p���[�V�X�e���Y
�ɂ�����镴�������̂��щ������A���Ђ̊��������ׂĎO�H�d�H�ɏ��n���A���̎��Ƃ���P�ނ���B
����́A���v�d���̑I���ƏW�����������A�C���t����IT�Ɍo�c�������W�����A�C�O���Ƃ̋����ɏ��̐��Â�����}���B
�[�[�[
������Ђɂ��ƁA�摜�f�f�@��ł̓h�C�c�̃V�[�����X���V�F�A23.1%�Ńg�b�v�AGE��21.8%��2�ʁA�I�����_�̃t�B���b�v�X��20.5%�ŁA�L���m��(9.5%)�A�x�m�t�B����(5.5%)�A����(2.9%)�Ȃǂ������B
�x�m�t�C�����͈�×p�摜�Ǘ��V�X�e���ł͐��E�V�F�A�Ŏ�ʁi17.5%�j�Ɉʒu���邪�AMRI��CT�Ƃ�������Ë@��������Ă��Ȃ������B
�x�m�t�C�����z�[���f�B���O�X�́A�����̎��C���摜���u�iMRI�j�Ȃǂ̈�Ë@��ɕx�m�t�C�����Ǝ��̉摜�����Z�p��l�H�m�\�iAI�j�Ȃǂ̃\�t�g�E�G�A��g�ݍ��킹�ꊇ���Ē��A�C�O���3�Ђ�ǂ��グ��B
2019/12/20�@�����A �O�H�d�H�ƂƂ�JV�̑������S���߂��镴���Řa���A�Η͔��d���Ƃ���P�ށ@
�������쏊 ��12��18���A������ �O�H�d�H�� �� �Η͔��d�V�X�e�����Ƃ�����JV�� �O�H�����p���[�V�X�e���Y �����g �� ��A�t�� �J���a���̃{�C���[���݃v���W�F�N�g �̏��p �� �ւ��āA �a�� �������� ��
�Ɣ��\�����B
�a���Ɏ���܂ł̌o�܁F
�O�H�d�H�ƂƓ������쏊��2014�N2���ɗ��Ђ̉Η͔��d���̃C���t�����Ƃ����A�O�H�d�H�� 65%�A�������쏊 35%�o���ŁA�O�H�����p���[�V�X�e���Y��ݗ������B
�O�H�����p���[�V�X�e���Y�����p�����������ƂŖ�肪�������B
������2007�N����2008�N�ɂ����āA��A�̓d�͉�� Eskom ����A���Ђ����݂���Medupi ���d������� Kusile���d�������Ɋe6��A�v12��̐ΒY�Η͔��d�v�����g�p�{�C���[�ݔ��z��5,700���~�Ŏ����B�������A1��ڂ̉^�]�J�n�������\���2012�N����2015�N�ɂ��ꍞ�ނȂǍH���͑啝�ɒx��
�A�����c��B�v�̌������Ȃǂō������H���Ă��Ȃ��B
���̎��Ƃ��O�H�����p���[�V�X�e���Y�������p�����߂̌_��ł́A
�O�H�d�H�́A�������͔��������_�ɂ����Ċ��ɑ����������܂ꂽ�v���W�F�N�g�ł���A�����Ȃǂɖ�肪�������Ƃ��āA�O�H�����p���[�V�X�e���Y������ɔ����������������������S���ׂ����Ǝ咣��
�A2016�N3���ɖ�3,790���~�̐������s�����B
�����͓��N4���ɁA�_��Ɋ�Â��@�I�����Ɍ����邽�ߐ����ɉ������Ȃ��|�������B
�O�H�d�H�́A2017�N3���ɂ͐����z���7,634���~�ɑ��₵���B
���̌㗼�Ђŋ��c���Ă������A�܂Ƃ܂�Ȃ������Ƃ��ĎO�H�d�H��7��31���A��O�҂ɉ������ς˂钇�ق̎葱�����A���{�������ً���ɐ\�����Ă��Ɣ��\�����B
2017/2/13�@�O�H�d�H�Ɠ����A��A�̉Η͔��d�v�����g�H���ő���
���Ђ͒��َ葱���ƕ��s���ċ��c�𑱂��Ă������A����A���L�̒ʂ�a���Ɏ������B
1)
������ �A �O�H�����p���[�V�X�e���Y �̓��� ���L�����S�� ( �ۗL�䗦 35% ) ��
�O�H�d�H�� �Ɉ����n��
�A�Η͔��d���Ƃ���P�ނ���B
2) �����́A�O�H�d�H�Ƃɑ��A2000���~�̔��������x�����B �O�H�����p���[�V�X�e���Y �̎q��Ђɑ������700���~�ŎO�H�d�H�Ƃɏ��n����B
3)
�O�H�d�H�Ƃ͊����ƌ����̎�̌�A���ِ�������艺����B
�@
������2020�N3�����Z�œ��ʑ����Ƃ���3,780���~���v�シ��Ɣ��\�����B
�a���� -2,000���~
�����n 700���~
���������x�� -1,300���~
JV ������ -2,480���~
�������v -3,780���~
����700���~�ŏ��n���A�a�����Ƒ��E���邽�߁A�����x������1300���~�Ő������B
�����x��������1300���~���ɂ���ꍇ�A���ɕ]�������ĕ뉿���[���Ƃ��Ă������700���~�ŏ��n����K�v������B
���炭�����Ǝv���邪�A���\�ł͕s���B
���\�̂Ƃ���ł���A���ʓI�ɂ́A2016�N3���ɎO�H�d�H�Ƃ��������A���������ۂ������z�̎x�����Ō����������ƂƂȂ�B
2019/12/20�@�ċc��A�\�Z�Ă���
�g�����v�哝�̂̒e�N�ő呛���̕č��c��͎b��\�Z�̊����꒼�O��12��19���ɗ\�Z�āi2019/10�`2020/9�j�������A�哝�̂ɑ������B �g�����v�哝�̂͏�������Ƃ݂��A���{�@�ւ̈ꕔ���͉�������B
�t�L�@�哝�̂�12��20���ɏ������A�\�Z�͐��������B
�\�Z�������ẮA 7��22���ɁA����2�N�Ԃ̘A�M���{�̍Ώo�ƍ��̏���ɂ��ė^��}�ō��ӂ����B2020��v�N�x�i2019�N10���`20�N9���j��21��v�N�x�̍Ώo������v3200���h�������グ��ق��A������� ���ẮA 2021�N7�����܂�2�N�ԒI�グ����B
2019/7/25�@��
�Ώo����ƍ�����������グ �@
�������A��̓I�ȗ\�Z�ɂ��Ă� �g�����v�哝�̂��I������Ɍf����u�����̕ǁv�̌��ݔ�ȂǂőË��_�����������Ă��炸�A�i�W���Ȃ��A9��27���� �ĘA�M���{�̎x�o��2019�N�̃��x����11��21���܂Ŏ蓖�Ă���Ȃ��\�Z���ʂ����B
2019/9/30�@ �ĂȂ��\�Z�������A11��21���܂ŋ��c�p��
�g�����v�哝�̂�11��21���A12��20���܂ł̎b��\�Z�Ăɏ����A�b��\�Z�����ɂ�萭�{�@�֕��͐��O�ʼn�����ꂽ�B
2019/11/25�@�g�����v�哝�́A�b��\�Z�Ăɏ���
�A���{�������
�@
���̊������߂Â��Ȃ��A�哝�̒e�N�̋c�_�̍Œ��A�c��͐��T�Ԃɂ킽�蒴�}�h���c���s�Ȃ��A�����Ǝb�荇�ӂ����B
�@�Ă̋K�͂�1��4000���h���ŁA�Љ�ۏ��Ȃǁu�`���I�v�o��͍���̖@�Ăɂ͊܂܂�Ȃ��B�Ώo���͍����Ԏ��̊g��������A2019��v�N�x�̍����Ԏ���9840���h���ƂȂ�B�c��\�Z�ǁiCBO�j�́A����10�N�̍����Ԏ��̔N�ԕ��ς�1��2000���h���Ɨ\�z���Ă���B
���h���Ȃ̗\�Z�́A�O�N�x����220���h�����z��7,380���h���ƂȂ����B�g�����v�哝�̂��ڋʐ���Ƃ��Čf����F���R�n�݂Ɋւ���\�Z�����荞�܂ꂽ�B
�g�����v�哝�̂̓��L�V�R�����̕nj��ݔ�Ƃ���50���h����v�����Ă������A�\�Z�Ăɐ��荞�܂ꂽ�̂͑O�N�x���݂�13��7000���h���ɂƂǂ܂����B�A���A����}�������Ă����R���\�Z�̕nj��݂ւ̓]�p���\�Ƃ��邱�ƂŐ܂荇�����B
���L�����荞�܂ꂽ�B
��R�l�̋��^�ς�3.1%�����グ�B
��҂̋i����Ƃ��āA�����̍Œ�w���N������s��18����21�Ɉ����グ��[�u�B
�I�o�}�P�A�i��Õی����x���v�@�j�̍������x����ړI�őn�݂��ꂽ���̂́A����������ƂȂ����łȂǂ̔p�~�B
�n�������̂����N11���̑哝�̑I����ыc��I���̏����ɏ[�Ă��p.�B�T�C�o�[�U���ɑ���C���t�������Ȃǂɏ[�Ă�B
���\�N�ԓ�������Ă����e�ƍ߂Ɋւ��錤���\�Z�B
����}�͍ٗʓI�o����s�������440���h�������邱�ƂɂȂ����Ɛ��ʂ����������B�y���V���@�c���́A�u�S�Ă̖���}���́A�č����̌��N����Z�ʂ̈���A�����ɂƂ��đ傫�ȏ����ƂȂ������̗͋����Ώo�p�b�P�[�W��傢�Ɍւ�Ɏv���Ă悢�v�Ƙb�����B
�@
���@��12��17���A�e�Ȓ��̗\�Z�̂����A���h���Ȋ֘A�Ώo�@�ĂƔh�Ȓ��Ȃǂ̍Ώo�@�Ăɕ����ē��[���A���ꂼ��������B
���̖@�ẮA���h���ȁA���y���S�ۏ�ȁA�����ȁA�i�@�ȁA�����Ȃ��̑��̍Ώo
�@
���a�} ����} ������ ���v
�^�� 130 150 �@
280
���� 62 75 1 138
���� 5 7 �@
12
���v 197 232 1 430
���@���� 435�A���� ���� 4�A����}1������
���̖@�ẮA�_���ȁA�J���ȁA�����ȁA�^�A�ȁA�����Ȃ��̑��̍Ώo
�@
���a�} ����} ������ ���v
�^�� 79 218 �@
297
���� 112 7 1 120
���� 6 7 �@
13
���v 197 232 1 430
2�@�Ă͏�@�ɑ����A12��19���ɉ����ꂽ�B
���̖@��
�@
���a�} ����} ����n ���v
�^�� 46 34 1 81
���� 4 7 �@
11
���� 3 4 1 8
���v
53
45
2
100
���̖@��
�@
���a�} ����} ����n ���v
�^�� 31 39 1 71
���� 21 2 �@
23
���� 1 4 1 6
���v
53
45
2
100
2019/12/21�@�p���@�A���E�֘A�@�Ă̊�{���j�����A���N1��8���ɍ̌��@
�W�����\����12��20���AEU�ƍ��ӂ������E����Ă������@�ɔ��f����֘A�@�Ă��o�����B
�O��̖@�ĂɁAEU�Ƃ�FTA�̒������Ԃɍ���Ȃ��ꍇ�ł��A���N12�����܂ł̈ڍs���Ԃ�����������AEU�@�̉p���ւ̓K�p��~��������������ł��Ȃ����������t���������B
���@��12��20���A���E�֘A�@�Ă̑��lj���s���A�@�Ă̊�{���j�� 359 �� 234
�ʼn������B���̌�A���������߂�c���i�s���c�� 353 �� 243�ʼn������B
���̌�A���N1��6����7���Ɉψ���R�c���s���A1��8���ɑ�O�lj�ōŏI�R�c���s���B
�^�}�ێ�}�͍���̑��I���ʼnߔ����Ă���A���N1��31���̗��E�͊m���ɂȂ����Ƃ݂���B
�c��̖@���R�c�͎��̒ʂ�s����B
�� ��lj�i First
Reading �j
�{��c�Ŗ@���Ă̑薼�N��
�� �� �lj�i Second
Reading �j
�{��c�Ŗ@���Ă̊�{���j�R�c�i���̌�́A ��{���j����O���C���Ă͋�����Ȃ��j
�c���i�s���c �i Programme
Motion �j
���̌�̖@ ���ĐR�c�̓��� �\��
�ψ���i�K�i Committee
Stage �j
����R��
��O �lj�i Third
Reading �j �{��c�ł��@���čŏI�R�c
10���̗��E�֘A�@�Ă̐R�c�ł́A10��22���� �u���lj�v�c�Ă�329��299�ʼn������B �@ ���E�֘A�@�Ă𑁊��ɐ��������邽�߂ɐ��{����o�����u�c���i�s���c�v��308��322�͍̋��Ŕی����ꂽ�B
2019/10/23
Brexit �̉��� �Z����
���̌�A���I���ƂȂ�A����̈����ƂȂ����B
�c�Ȃ̐��ڂƍ��[���ʁF
�@
���U �O
2017/6/8
����
����
12/20
�^��
����
����
��
�ێ�}
330
317
298
365
353
�@
10
2
���哝��}(NI)
8
10
10
8
�@
7
1
�@
(�^�}�j
�[
(327)
(308)
�[
�@
�@
�@
�@
�J���}
232
262
243
202
6
162
32
2
�X�R�b�g�����h�����}(Scot)
56
35
35
47
�@
45
2
�@
���R����}
8
12
20
11
�@
11
�@
�@
�Ɨ��}
1
0
0
1
�@
1
�@
�@
�Ɨ��O���[�v
�@
0
24
�[
�@
�@
�@
�@
Change UK
�@
�@
5
0
�@
�@
�@
�@
�V���t�F�C���}(NI)
4
7
7
7
�@
�@
7
�@
�u���C�h�J����(Wales)
3
4
4
4
�@
4
�@
�@
�̓}
1
1
1
1
�@
1
�@
�@
�Љ��J���}(NI)
3
0
0
2
�@
2
�@
�@
�k�A�C�������h�����}(NI)
0
0
0
1
�@
1
�@
�@
�A���X�^�[����}(NI)
2
0
0
0
�@
�@
�@
�@
������
1
1
0
0
�@
�@
�@
�@
�c��
1
1
1
1
�@
�@
�@
1
���
0
0
2
0
�@
�@
�@
�@
���v
650
650
650
650
359
234
52
5
�c���ƕ��c���i3�l�F���I�C�j�A�V���t�F�C���}�i7�l�j�͓��[�����B
�t�L�@2020/1/8
���c�����I�C���ꂽ�B�ێ�}����2�l�A�J���}����1�l�ƂȂ����B
�[�[�[
�p�c��@��12��17���ɍĊJ���A��������̋c���I�C�i Sir
Lindsay Hoyle ���ĔC�j�Ƌc���ɂ��鐾���s��ꂽ�B
���I���O�� 10��31����John
Bercow���@�c�����c�������ނ����B��C�̋c���̑I�C��11��4���ɍs���A�J���}��Sir Lindsay Hoyle���c���ɑI�C���ꂽ�B
�k�A�C�������h�I�o�̃V���t�F�C���}�͂������ƌ���i�G���U�x�X2���j�ւ̐鐾 �����ۂ��A�o�@�������A �c���Δ������Ă������B
Sir Lindsay
Hoyle�c���I�C�ŁA�J���}��202�c���ƂȂ����B
�G���U�x�X������12��19���ɃW�����\�������̎{�����j��ǂݏグ���B
���N1������EU���E���ŗD��ۑ�Ƃ��炽�߂ĕ\�����A���E�̈ڍs���Ԃ��������Ȃ����Ƃ������B
�uEU���E��B�����邱�Ƃ��D��ۑ�ł���A�p����1�����ɗ��E����v�ڍs���Ԃ�2020�N�ȍ~�ɉ�������\����r�� ���A����ȏ���S�O��x����������v
�܂��A���E���FTA�Ɋ�Â�EU�Ƃ̏����W��͍�����ƂƂ��ɁAEU�ȊO�̎�v�o�ύ��Ƃ��ʏ������J�n����Ƃ����B
�ڍs���Ԃ�2020�N12�����܂łƂȂ��Ă���A�o�������ӂ���Έڍs���Ԃ̉�����2�N�܂ł��F�߂���B
EU�Ƃ��ẮA�p�����ȒP�ɁA�L���ɗ��E�o�����ꍇ�A����A���E����]������������o��\�������邽�߁A�p���Ɍ������p���������Ă���B
�������AFTA�����ԓ��ɔ��������A���ӂȂ� ���E
�Ɏ����ɂȂ邱�Ƃ�EU�ɂƂ��Ă��D�܂����Ȃ��B
2019/12/22
�ĕ����h�̗L�͎��A�g�����v�哝�̂̔�ƌĂт���
�L���X�g�������h�͕Đl����4����1���߂�Ƃ����ő�̏@�����͂ŁA�g�����v�đ哝�̂̎x����ՂƂȂ��Ă���B
�����h�̎w���I�q�t�Ƃ��ĕێ�h�ɋ����e���͂������A�g�����v�����x������Billy
Graham �i2018�N2���Ɏ����j���n�������G�� Christianity
Today ��12��19���A�u�g�����v�͔�Ƃ����ׂ����v�iTrump Should
Be Removed from Office�j�Ƒ肷��_�]���f�ڂ����B�@ �@ https://www.christianitytoday.com/ct/2019/december-web-only/trump-should-be-removed-from-office.html
���e�͎��̒ʂ�B
�{���̑n�ݎ҂� Billy Graham ���AChristianity
Today �͕����h�̃N���X�`�������M�̖ʂ���j���[�X�𗝉�����̂�������Ƃ����B
�哝�̂͐��G�̕]���𗎂Ƃ����߁A�����̌��͂��g���ĊO����]�ɓ����|�����B���������s�ׂ͌��@�ᔽ�Ƃ��������łȂ��A�ɂ߂ĕs�����I���B
�哝�̂͐����œ����T�O���̂ċ������B
�����h�x���҂́A�ނ̍ō��ٔC���A�@���̎��R�̕ی�A�o�ω^�c�Ȃǂ��x������B�������A�e�N�̃q�A�����O�ŁA�l�̗��v�̂��ߌ��͂𗐗p���A���@��̐���𗠐����B�哝�̂̓������@�����炩�ɂȂ����B�哝�̐��������A�č��̈АM�������A�č����̐��_�Ɩ������������B�Ɛт��������I�A�����I�댯�̕����傫���B
�g�����v������@�Ŕ�Ƃ��ׂ����A���̑I���ŗ��I������ׂ����́A�T�d�Ȕ��f��v�����肾�B�g�����v���̔�Ƃ͓}�h�ł͂Ȃ��\���̑n����ւ̒����S�����������ƂȂ��Ă���B
����ɑ��A�哝�̂�12��20���A�u�ɍ��G�����v�u�����ǂ܂Ȃ��v�Ȃǂƃc�C�b�^�[�Ŕ��������B�u���قǕ����h�̂��߂ɐs�͂����哝�̂͂��Ȃ��v�Ƃ��q�ׂ��B
A far left magazine, or very �gprogressive,�h as
some would call it, which has been doing poorly and hasn�ft been involved
with the Billy Graham family for many years, Christianity Today, knows
nothing about reading a perfect transcript of a routine phone call and would
rather have a Radical Left nonbeliever, who wants to take your religion &
your guns, than Donald Trump as your President. No President has done more for the Evangelical
community , and it�fs not even close. You�fll not get anything from
those Dems on stage. I won�ft be reading ET again!
I
guess the magazine, �gChristianity Today,�h is looking for Elizabeth Warren,
Bernie Sanders, or those of the socialist/communist bent, to guard their
religion. How about Sleepy Joe?
Billy Graham�̑��q��Franklin
Graham�́A���̎G����n���������� ���̘_�]�ɓ��ӂ��Ȃ��������낤�A���]���Ă��邾�낤�Əq�ׂ��B���͐^�̃g�����v��m���Ă���A�ނ�M���A�ނɓ��[�����B�g�����v�������ɕK�v�Ȑl�Ԃ��ƐM���Ă����Ƃ��q�ׂ��B
CT Magazine released an editorial saying
Trump should be removed from office & they invoked my father�fs name, so I
felt I should respond.
I hadn�ft shared who my father Billy
Graham voted for in 2016, but because of CT Magazine�fs article, I felt it
necessary to share now.
Franklin Graham�� �u�g�����v�������_���猭�킳�ꂽ�哝�̂��v�Əq�ׂĂ����B
�[�[�[
�����h�͐����̐M�ɖڊo�߂��ێ�I�ȃv���e�X�^���g�̑��́B
Billy
Graham�͕����h���\����w���҂ŁA�S�Ċe�n�ɂƂǂ܂炸�A���E185�̍��ƒn��œ`�����A2������l�X�ɋ�����������Ƃ���Ă���B�g���[�}���ȍ~�A��シ�ׂĂ̑哝�̂Ɛe�����W�������Ƃł��m���Ă���B
�哝�̑I���ł́A�g�����v��₪�����h���爳�|�I�����̎x�����W�߂����Ƃ�����������Â���v���̂ЂƂɂȂ����B�����h����̎x������81���ɏ�����B
�g�����v���́A�ō��ق��͂��ߘA�M�����ɕێ�h��I�Ԃƌ��A�D�P����Ȃǂɋ����������B�C�X���G���̃A�����J��g�ق��G���T�����Ɉړ]����ƌ��A���̒ʂ肵�Ă���B
�@
METI��10��17���A2023�N�܂ł̐��E�̃G�`�����n�E�v���s�����n�U���i�y�іF�������i�̎����i���v�A���Y�\�́A���Y�ʁj�̓������Ƃ�܂Ƃ� �A���\�����B
���\���e�͎��̒ʂ�B
���i�ʍ��ʂ̎��v�E�\�́E���Y���O���t�������B https://knak.jp/METI-world/meti-2019/index.html �@
���L�����F 1�D�����̓�����
�����ɂ����� �V���v��� ���������v��E��������Ă���B �� 13 �� 5 ���N�v��i 13-5 �v��j�ł́A�� �������^�G�`�����R���r�i�[�g�Ƃ��� 2020 �N�ȍ~��ړr�ɂV�̒n��ɏW��A�����̑��l���A���� ��A�G�l���M�[�z�^���܂߂��A�V�K�G�`�����v�����g�̍\�z���ł��o����Ă��� �B
2�D�č��̃V�F�[���v���̉e��
�č��ɂ����ăV�F�[���R���� �G�^���R���v���b�N�X�̍X�Ȃ� �V���v�悪�\�肳��Ă���A 2030 �N��ړr�ɕč��̃G�`���������\�͂� 5 �疜�d�K�͂� �g�傷�錩�ʂ��ƂȂ��Ă���B
��N�x 1Q �ȍ~��
DowDupont /Chevron Phillips/ExxonMobil �� 150���g�� �̃��K�R���v���b �N�X�̉ғ��J�n�ȍ~�A�\�z�ʂ�A�č����G�`�����n�Ή��i�̈��A�o��n�����A���O�ʂ�O���[ �o���ȐΉ������A�s���ɉe����^���n�߂Ă���B
�����ɃX�^�[�g�����Ē� �o�ϖ��C���傫���e�����A�O���[�o���ȃg���[�h�ɑ傫�ȕω��������炵���B
�č��ł͌����Ȍo�ϐ�������ɓ����̐L�т����҂���邪�A����Ŋ��ɃG�`�������Z�Ŗ� 800 ���g ���A�v���s�������Z�Ŗ� 100 ���g���̗A�o���߂ƂȂ��Ă���A����ғ�����V���v��̑啔�����A�o �Ɍ������Ɨ\�z����A���ɗU���i�Ƃ��Ă� PE �A EG �𒆐S�Ƃ����A�o���� 2019 �` 20 �N�ȍ~�̃O�� �[�o���ȃ}�[�P�b�g�ɗ^����e�������O�����B
�܂��A�G�`�����ł̗A�o�������X���ɂ���A����̗A �o�p�^�[�~�i���̑�������ŁA�X�ɑ���������̂Ɨ\�z�����B
�T�v�͈ȉ��̒ʂ�B
�P�D���E�̃G�`�����n�U���i
�P�j���Y�\�� �Q�j���v
�@
�R�j���E�̃G�`�����n�U���i�̎����o�����X�i�G�`�������Z �S���g���j
�@ �@ ���E�v �A�W�A�v �������� �k�Čv �����v
2017 �\��
178.2
70.7
29.0 35.2 31.1
���Y
154.0
59.0
25.0 33.9 28.1
���v 149.7 74.1 44.1 25.7 9.6
�o�����X
4.3
-15.1
-19.1
8.2
18.5
2023 �\�� 222.8 97.9 48.4 45.1 33.8
���Y 193.4 81.3 39.1 42.4 32.3
���v 182.5 94.8 59.1 28.9 12.4
�o�����X
10.9
-13.5
-20.0
13.5
19.9
�@
�Q�D���E�̃v���s�����n�U���i
�P�j���Y�\�� �Q�j���v
�R�j ���E�̃v���s�����n�U���i�̎����o�����X�i�v���s�������Z
�S���g�� �j
�@ �@ ���E�v �A�W�A�v �������� �k�Čv �����v
2017 �\��
117.0
52.9
34.2 17.4 10.3
���Y
104.4
55.5
29.5 14.7 9.5
���v 98.7 56.4 34.3 14.0 3.6
�o�����X
5.7
-0.9
-4.8
0.7
5.9
2023 �\�� 147.6 86.7 50.8 19.8 12.0
���Y 130.4 76.5 43.1 15.9 11.1
���v 120.0 71.8 45.5 15.2 5.0
�o�����X
10.4
4.7
-2.4
0.7
6.1
�R�D��v���i�̎����@�i���\�́A�����Y�ƒn��ʎ��v�j
�@
�@
�@
�@
�@�@�@PS�͐��Y�����v���펞�傫��������Ă���A�������Ɍ�肪����Ǝv����B
�@
�@
�@
�@
�@
���̏��i�̃O���t�@�y�я��i�ʂ̍��ʂ̎��v�E�\�́E���Y�̃O���t�͉��L�ɂ���܂��B
https://knak.jp/METI-world/meti-2019/index.html
�@
2019/12/24 �T�n����1��LNG�v��@
12��20���t�̓��{�o�ϐV���́A�T�n����1��LNG�v��ɂ��āA ���{�̊������ăG�N�\�����[�r���ȂǂƋ����Ŏ��Ƃ𐄐i������j���ł߂��ƕ��B
�G�N�\���ƃ��V�A���c�Ζ���Ѓ��X�l�t�`�̂ق��A�o�Y�Ȃƈɓ����A�Ζ������J���A�ۍg�Ȃǂ��o������u�T�n�����Ζ��K�X�J���v
�Ȃǂ̊�ƘA�������Ƃ𐄐i������j�Ƃ����B
�f�J�X�g���`�ŔN�Y620���g���̐��Y�\�͂�����LNG�v�����g�̌��݂�ڎw���Ă���B 2027�N�ɂ����Y���n�߁A���Ɣ��1���~�K�͂ɂȂ錩�ʂ��B���V�A�͓V�R�K�X�̋���������B����A�W�A�ɂ��L�������ӌ��ŁA���{�����V�A�Ƃ̊W�����������B�𑽗l������B
�T�n����1�v���W�F�N�g�̊T�v�͉��L�̂Ƃ���B
���Ǝ��
�E Exxon
Neftegas �@30�� ONGC Videsh �i�C���h�A20���j Sakhalinmorneftegas-Shelf �i���V�A�A11.5���j Rosneft -Astra
�i���V�A�@8.5���j
�� �� �z ��120���h���ȏ�
�J���z��
�I�h�v�g��`���C���H��A���N�g���E�_�M
����� �@���@�@�@��23���o����
�T�n�����Ζ��K�X�J���ɂ́A �o�ώY�Ƒ�b
50.00%�A �ɓ����O���[�v
16.29% �A �������J��
15.3 %�A �ۍg
11.68%�A ���ېΖ��J�����
5.74% ���o���i�[���ٓ�����j
�`���C�E�H���K�X�c����́A2005�N10�����A�C��̃v���b�g�t�H�[���◤��̍B���n�E�����{�݂Ȃǂ̐��Y�{�݂�p���Č����E�V�R�K�X�����Y����Ă���B2015�N4���ɂ͑���@���13,500m�Ƃ������E�Œ��L�^��B�������B�I�h�v�g���K�X�c�ł�2010�N9������A�A���N�g���E�_�M���K�X�c�ł�2015�N1�����e�X�������Y���J�n���Ă���B
�����ƃK�X�̗A���ɂ��Ă͉��L�̒ʂ�B
�@���Ζ����T�n�������𓌐��ɉ��f���嗤���Ɏ���p�C�v���C���ʼn^�����������^���J�[�œ��{���֗A�o �@���K�X��
�����Ă� ��k�C���̓����̈ꕔ(�Ύ땽��)���o�R����C��p�C�v���C���ɂ��^�� ����\��ł��������A
�p�C�v���C���~�݂̋��ƕ⏞����A�ő���v�ƂɂȂ�Ƃ݂�ꂽ�����d�͂��w���ɓ�F�����������߁A���̌v��͔����ƂȂ����B
���̌� �A �K�X�v�����Ɖp�����C�����E�_�b�`�E�V�F�����哱����u�T�n����2�v �i��[�̃v���S���h�m�G�܂Ńp�C�v���C���ʼn^�����A�t���j�ɃK�X��̔�����v�悾�������A���i�������A���O��LNG��A�o������j�ɓ]�������B
�K�X�̉t���ɂ��ẮA�����̓��X�l�t�`�ƃG�N�\�����ЂŌ��݂�����j�������B
���Ђ�2013�N��LNG�v�����g�̌��v����v�[�`���哝�̂ɒ����B�������A�E�N���C�i������������V�A���قȂǑ����̗v�����d�Ȃ�A���݂܂Ŏ������Ă��Ȃ��B
2018�N10���ł́A���ЂɃT�n�����Ζ��K�X�J���ƃC���h��ONGC��������4�Ђł̌��݂ɕύX���ꂽ�B
LNG�̐��Y���̂͌o�ϐ��ق̑Ώۂł͂Ȃ����A���V�A��Ƃ͐��قɂ����Z�s��ւ̃A�N�Z�X����������Ă���B �T�n�����Ζ��K�X�J����ONGC���ЂƑg�ނ��ƂŁA�R�X�g�S�ł���ق��A���قɔ������X�N��a�炰��_��������Ƃ݂���B
�@
�T�n�����v��ɂ��Ắ@https://knak.jp/blog/2006-6-1.htm#sakhalin
�T�n����1�v��ɂ��Ă� �@ 2018/7/25
���V�A���c�Ζ���� Rosneft�A�T�n�����P�̎Q���҂��i
�T�n����2�v��ɂ��Ắ@2 007/1/9�@�T�n�����Q�v��@�ăX�^�[�g�Ƃ��̔w�i �@
�@
2019/12/25�@���a�d�H�A����������TOB�@
���a�d�H��12��18���A�����������������J�����t���iTOB�j�ɂ�蔃������Ɣ��\�����B
12�����߂ɁA�������쏊���O���[�v�̒��j�q��Ђł��鉻�w���A���������̔��p������A���a�d�H�ɔ����̗D�������^���邱�Ƃ����߂��ƕ��Ă����B
2019/12/2
�������쏊�A�q��Г������������a�d�H�ɔ��p�ց@
���\�ł́ATOB���i�͂P��4,630�~�A���t����͑��z9640���~�ƂȂ�B
���a�d�H��2020�N3��23���A���������ɑ���TOB��3��24���Ɏn�߂�Ɣ��\�����B���Ԃ�4��20���܂łŁA1��������4630�~�A�������z�͖�9600���~�B
TOB�̑O��Ƃ��Ă������{�A�����A�؍��A�č��A���B�A���y�ё�p�̓Ɛ�֎~�@�̐R����ʉ߂����B
�t�L
TOB�̌��ʁA87.61%���擾�����B�擾���z��
8,445��69�S���~�B4��28���t�ŏ��a�d�H�̘A���q��ЂɂȂ�B �S�������擾���A6�`7�����߂ǂɊ��S�q��ЂƂ��A���p�~����B
�@
�t�L
����������2020�N6��19���ɏ��p�~�ƂȂ����B�i1970�N�ɏ��j
6��23���Ɋ��S�q��Љ��B
���a�d�H��6��23���A�A���q��Љ��������������̎Ж���2020�N10��1���t�Łu���a�d�H�}�e���A���Y������Ёv(Showa Denko Materials
Co., Ltd.)�ɏ����ύX����Ɣ��\�����B
�@
�t�L
2021�N6���A�����������������̓d�q�@��ȂǂɎg���v�����g�z�����Ƃ��A���������t�@���h�̃|�����X�E�L���s�^���E�O���[�v�ɔ��p���邱�Ƃ����������B���p�z�͖�400���~�Ƃ݂���B
��������������A�������P�̂��ߎ��Ɣ��p��i�߂Ă���B
�[�[�[
�����A�O�䉻�w�Ȃǂ̑������w���[�J�[��ē����t�@���h�Ȃǂ��������グ�����A�����z�ȂǂŐ܂荇��Ȃ������B2�����D�ō��l���������a�d�H���ŏI���ƂȂ����B
�����z�̖�1���~�́A���������̎��сi���㍂ 6,810���~�A������c�Ɨ��v
486���~�A����A�����v 287���~�F2019/3�A���j����݂āA��������Ǝv����B
�X�ɁA�ʏ�̔����ł����51%���擾���A�q��Ђɂ���悢�B���̏ꍇ��5,000���~�̎x�o�ōςށB
�������A����̏ꍇ�͎��̗��R��100%��TOB���K�v�ŁA1���~���K�v�ƂȂ�B��������ЂɂƂ��ď�Q�ɂȂ����Ǝv����B
�،���������O�A�ǂ���̎���ł����Ă��A���t����̊��������L������1/3����ꍇ��TOB�ɂ����{���`���t�����Ă���B
���s���x��A���J���t�҂́ATOB�ɍۂ��Ĕ����t���銔�����̐��ɂ��āA�����ݒ肷�邱�Ƃ��F�߂��Ă���B
�A���A���劔�����̐��̍��v���������Ƃ��́A�����̕����ɂ�艞�劔�傩�畽���ɔ��t�����s�����̂Ƃ���Ă���B
����̏ꍇ�A ����������11��25���̏I�l��3,465�~�ł������B���d��TOB���i��1��4,630�~
�ŁA�S���傪���傷��̂͊m���ł���B
���́A�������쏊�͎����i51.29%�j�S�Ăp����̂��ړI�ł���B���d������51%��TOB�������ꍇ�A�����������̂́A���ɂ��A26.2%�ɂƂǂ܂��Ă��܂��B
�[�[�[
���a�d�H�� �ATOB�����҂Ƃ��Ċ��S�q��Ђł���HC�z�[���f�B���O�X��ݗ����A ��������9700���~�����ɂ��蓖�Ă���B
���d
�݂��ً�s����̗Z��
2,950���~
HC �z�[���f�B���O
�݂��ً�s�A���{����������s��A��D�抔�s
2,750���~
�݂��ً�s����m�����R�[�X���[��
4,000���~
���v �@
9,700���~
�D�抔�ƃm�����R�[�X���[���i���������̕ԍϔ\�͂Ɉˋ��j�̊��p�� ��菺�a�d�H�� ���ړI�ȏo�����z ��}�� ����B �������B�͗\�肹���A ������ ���͔���Ȃ� �B �������S�͇@��2,950���~�ɂƂǂ܂�Ƃ��Ă���B
������A���Ђ�2�� �X�e�A�����O�E�R�~�b�e�B��ʂ��Ď��Ɠ�����i�߂�B �@ ���ƃ|�[�g�t�H���I�E�}�l�W�����g�A�����A�\�Z����� �������B�ɌW��ӎv���� ������Ƃ̐i���Ǘ��E�ē�
�����擾�� 1 �N���� �r�� �����I�ȓ��� ��ڎw���B
�@
2019/12/26�@��EPA�Ǝi�@�ȁA������Roundup�̔�����Q�ٔ���Bayer���x���̈ӌ����@
�@
���݁A���2�Ԗڂ̍ٔ��̍T�i�R���T���t�����V�X�R�ōs���Ă���B
���̍ٔ��ł́A�ٔ����͒����I�����͍�������Ƃ��đ啝�Ɍ��z�������A�u������Roundup�̃��x���ɂ͔����̊댯��������Ă��炸���ׂł���v�Ƃ̔��R���̔��f�ɂ��Ă͔ے肹���A�L�߂ɂ����B
�T�i�ق�Bayer�́ARoundup�����̌����ł͂Ȃ��Ƃ��A���߂��咣�����B
��EPA�Ǝi�@�Ȃ�12��20���Afriend of the court brief
(��amicus curiae�F�ʎ����̖@�����ő�O�҂��ٔ����ɒ�o������܂��͈ӌ��j���o�����B
���̂Ȃ���EPA�́AEPA��Roundup�̃��x���ׁA���F�������ƁARoundup�ɂ͔������͂Ȃ��A���̂��߁A�������̊댯��\������K�v���͂Ȃ��Ƃ����B�����͕����ׂ��ł���Ƃ��Ă���B
EPA�͔�������F�߂��A���i���x���ɂ͓��R�A�������̊댯�͕\������Ă��Ȃ��B�������A�J���t�H���j�A�B�͔��������i�̃��X�g�Ɋ܂߂Ă���A�������̊댯���\������Ă��Ȃ��͈̂�@�ƂȂ�B
�B�@�Ɋ�Â��A�A�M�@�ł̃��x����ے肵���`�ƂȂ��Ă���B
EPA�Ǝi�@�Ȃ́A���x���͖@���ŔF�߂����̂ŁA����ƈقȂ�����ł̎g�p�͖@���ᔽ�ł���Ƃ��A�B�͔_��̔̔���g�p�𐧌����邱�Ƃ͏o���邪�A�������F�������x���ƈقȂ���́A�lj��������̂����߂邱�Ƃ͏o���Ȃ��Ƃ��Ă���B
�[�[�[
�w�i���ȉ��̒ʂ�B
2015 �N 3 �� �� WHO �̉����g�D�ł��� ���ۂ����@�ցi IARC �j�� �A Roundup �̗L�������ł��� glyphosate
�� �O���[�v 2 A �i �q�g�ɑ��Ă����炭�������� ��j �ɕ��ނ����B�O���[�v2A�́A�u �q�g�ւ̔����ɂ��Ă͌���ꂽ�؋������Ȃ����A���������̔�����ɂ��Ă͏\���ȏ؋�������ꍇ�v�ł���B
�������A���̔��f�͕č�EPA��EU�A���B�A�j���[�W�[�����h�A�h�C�c�A���{�A�J�i�_�ȂNJe���̊W�Ȓ��̔��f�ƈقȂ�B
EPA��2017�N12���Aglyphosate�́gnot likely to be
carcinogenic to humans�h�Ƃ̔��f���Ċm�F�����B
�������Ȃ���A�J���t�H���j�A�B�ł͏�LIARC�̔��f�Ɋ�Â� �Aglyphosate�� �u�J���t�H���j�A�Ŕ�����������ƒm����v�gProp
65�h chemicals �̃��X�g�Ɋ܂߂��B�����āA
glyphosate���܂ސ��i�ɂ͌x�����x�����L�ڂ��邱�Ƃ����߂��B
�v���|�W�V����65�iProp
65 �j�́A�������̂��u1986�N���S����������їL�Q�����{�s�@�v�Ƃ����A1986�N11���̊����[�����Ƃ��ėL���҂ɂ���Đ��肳�ꂽ�B
���̌��ʁA�ٔ��ł͔������̌x�������x���ɂȂ������Ƃ��ėL�ߔ����ɂȂ������B
�������AEPA�͖{������̖{�N8���Aglyphosate���܂ސ��i��o�^���Ă���S�ЂɎ莆�𑗂�Aglyphosate�̓q�g�ւ̔������͂Ȃ��Ƃ̔��f�Ɋ�Â��Aglyphosate���i���x����Prop
65 �̔������x�����ڂ��邱�Ƃ́u���ŁA�~�X���[�f�B���O�ł���v�Ƃ����B�iNat�fl Ass�fn of
Wheat Growers v. Zeise�j
2019/12/27
���V�A�ƃE�N���C�i�A
���B�����K�X�A�o�ō��Ӂ@
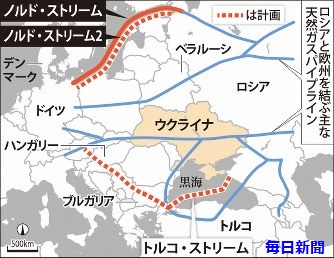
���V�A�ƃE�N���C�i��12��19���A2020�N1���ȍ~���E�N���C�i�̃p�C�v���C�����o�R���ă��V�A�Y�̓V�R�K�X�����B�ɋ������邱�ƂŊ�{���ӂ����B
���݂̗A���_���2019�N���Ɏ������邪�A�V�����_������Ԍ�����q���Ă����B
���V�A�ƃE�N���C�i�͓V�R�K�X������A���x�������Ă���A�E�N���C�i���o�R����p�C�v���C���Ń��V�A����V�R�K�X���Ă��鉢�B���������܂�Ă����B
���V�A�̍��c�K�X��ЃK�X�v�����̓h�C�c�Ɍ������u�m���h�X�g���[��2�v�ƃg���R�Ɏ���u�g���R�X�g���[���v��2�{�̑�^�K�X�p�C�v���C����2020�N�ɉғ�������\���
����B
Nord Stream -2
�͑S����1200�L�����[�g���ŁA�o���g�C��ʂ��ă��V�A�ƓƖk�������ԁB�A���\�͔͂N550���������[�g���ŁA���V�A�̉��B�ւ̃K�X�A�o�ʂ̖�4����1�ɓ�����B�N���Ɋ��H����Ƃ̊ϑ����o�Ă���B
�E�N���C�i���I�����V�A�Y�K�X�̗A�o���[�g�ł́A���C����g���R�ɗA�o���A����Ƀu���K���A��n���K���[�ȂǂɗA�o���� Turkish
Stream �����݂���Ă���B
2020�N�ɉ^�p�J�n�̗\��B
2019/11/9�@Nord
Stream -2 �A�N�����H��
���V�A���́u�m���h�X�g���[��2�v�Ɓu�g���R�X�g���[���v�̊J�ʂŁA�E�N���C�i�����ő����Ă���A�ߋ��ɃK�X�p�C�v���C���������ĉ��x���g���u�����N�����Ă����E�N���C�i�o�R�̗A���ʂ����炵�����v�f������B
����A�o�ς̈����ɋꂵ�ރE�N���C�i�͑����̗A���ʂ��m�ۂ��������_��ŁA���z�̒ʉߗ��邱�Ƃ�ڎw�����B
�X�ɁA�ߋ��̌_�s���������Ƃ��ăK�X�v��������A�����̑i�ׂ┱���̐��������݂Ă����B
�[�[�[
����̍��ӂ́A�_����Ԃ�5�N�ŁA�E�N���C�i�̃p�C�v���C�����o�R���鉢�B�ւ̋����ʂ�20�N��650���������[�g���A2021�N����400���������[�g���ƒi�K�I�Ɍ��炷�B
����Ƀ��V�A�͍��ۍٔ����̌���ɏ]���A�E�N���C�i�ɖ�30���h���̔��������x�����B���V�A����30���h���̎x�����ɓ��ӂ������Ƃ�
�A���̑i�ז��Ȃǂ͂ЂƂ܂���艺�����͗l�B
����ɂ��A���N�ȍ~�̃��V�A�̉��B�����K�X�A�o�͉��L�̒ʂ�ƂȂ�͗l�B
�E
�@
���� ����
�m���h�X�g���[�� 1
590��m3
�@��
�m���h�X�g���[�� 2
�[�[�[ 550��m3
�x�����[�V�o�R
420��m3
�@��
�E�N���C�i�o�R
800��m3 650��400��m3
�g���R�X�g���[��
�[�[�[ 315��m3
�u���[�X�g���[��
130��m3
�@��
�@
�Ȃ��A�č��ł�12��20���A�g�����v�哝�̂̏����Łu���h�����@�v�����������B
�č��́A���B�̃��V�A�ւ̃G�l���M�[�ˑ����[�܂邱�ƂŁu���B�̈��S�ۏ��̋��Ёv�ɂȂ�ƌ��O���Ă���A���h�����@�Łu�m���g�E�X�g���[���Q�v�ւ̐��ق����߂��B����A���炩�ɂȂ邪�A�~�ݎ��ƂɊW�����Ƃ����ّΏۂɂȂ錩���݁B
�č��̌�����A�~�ݎ��ƂɎQ������X�C�X���_��Allseas��12��21���A��Ƃ̒�~�\�����B
�p�C�v���C���̑�������1200km�̂����A�c��͖�130km�ƂȂ��Ă���BAllseas�Ђ̗��E�ŁA���Ƃ��哱����K�X�v�����͊W��Ƃɑ�s�����錟�����n�߂��B
�č��̐��قŁA���������N�㔼�ɂ��ꍞ�މ\������肴������Ă���B���u���t�I�O���́u�R�[�u�v���x���A�h�C�c�̃V�����c�����������́u�h�C�c�Ɖ��B�̎匠�ւ̐[���ȍU�����v�Ɣᔻ�����B
�@
2019/12/28�@�����A859�i�ڂ̊ň��������@
�����̍����@�Őő��ψ����12��23���A���N1��1������H�i��n�C�e�N���i�̕��i�Ȃ�859�i�ڂ̗A���i
�ɂ��āAWTO�������ɑ���Ōb���ŗ��iMFN�ŗ��j���Ⴂ�A���b��ŗ���K�p����Ɣ��\�����B
�����̌o�ϊJ�����A�s�[������ƂƂ��ɁA�������h������B
�[�[�[
��N�����l�̑[�u���s�����B
������������2018�N12��24���A2019�N�̗A�o���̊Œ����v��\�����B
2019�N1��1�����A�����Ԑ��Y���C�������Y�ƃ��{�b�g�Ȃ�706�i�ڂŌ��s�̍Ōb���ŗ������Ⴂ�b��ŗ����K�p�����B
2018/12/26
�����A���N1������ꕔ�i�ڂŊň�������
�[�[�[
�����859�i�ڂ̂����A�������×p�̃A���J���C�h�ވ��i�A�V�^���A�a���Ö�Y���錴���Ȃǂɂ��āA����R�X�g�����������A�V��̐��Y�𑣐i���邽�߂ɁA�[���ł����{����B
�܂��A�����Ŕ�r�I�������s�����Ă�����̏���𑝂₷���߁A�H�i�ɂ��ĐV���Ɏb��ŗ���݂����B
�A�t���J�R�����̗��s�ɂ�苟���s�����w�E����Ă���Ⓚ�ؓ��̊ŗ���12������8���Ɉ�����������B
����ɁA��i�Z�p�E�ݔ��E���i�̗A�����g�債�A�n�C�e�N�Z�p�Y�Ƃ̔��W���T�|�[�g���邽�߂Ƃ��āA�����Ԃ̃I�[�g�}�`�b�N�g�����X�~�b�V�����ɗp����g���N�R���o�[�^�[��A���~�j�E�����o���u�R�A�A�W�ω�H�iIC�j�X�g���[�W��t�H�g���W�X�g�p���U�t�Ȃǂ̔����̊֘A���i�ɂ��Ă��A�V���Ɋŗ���������������B
���n�̕ł́A�n�C�e�N���i�ɂ��ẮA�ꕔ�̍����R�A�ƂȂ镔�i�E�Z�p�E���ޗ��̋�����f���ƂŒ�����ƂɈ����������Ă���Ƃ��A������̗A�����g�傷�邱�ƂŃ{�g���l�b�N����������K�v�����邱�ƁA�܂��A�ꕔ�̍��������̃n�C�e�N���i�ɑ��ł������グ�Ă��邽�ߊ֘A��Ƃ��傫�Ȉ��͂ɒ��ʂ��Ă���A���i�⌴�ޗ��̊ŗ����������ɂ���āA����������Ƃ̃����j���O�R�X�g���팸�ł���Ƃ��Ă���B
����ŁA�������A���K�����������Ă���ő̔p�����̂����A�^���O�X�e���ƃj�I�u��2��̂����ɑ��Ă͗A���b��ŗ�����������A��荂��MFN�ŗ����ĂѓK�p�����B
1��1�������859�i�ڂ̊ł́F�@https://gss.mof.gov.cn/gzdt/zhengcefabu/201912/P020191220564315355326.pdf
7��1������̏��Z�p���i�̊ł́Fhttps://gss.mof.gov.cn/gzdt/zhengcefabu/201912/P020191220564315742803.pdf
2019/12/30�@�C�^���A�A�f�W�^���ېł��A
�t�����X�ɒǐ�
�C�^���A�c���c�@�i���@�j��12��23���A2020�N�̗\�Z�Ă��^��334�A����232�ʼn������B
���̂Ȃ��ŁA�t�����X�ɒǐ������f�W�^���ې� ��2020�N1��1�����������߂��B
���E�ł̔��㍂��7��5000�����[���ȏ�A�C�^���A������550�����[���ȏ�̔���グ�������Ƃ�ΏۂɁA�f�W�^��������3%�̐ŋ����ۂ��B
�l�b�g�L���≹�y�̃f�W�^���z�M�A�N���E�h�R���s���[�e�B���O�Ȃǂ��肪�����Ƃ��ΏۂƂȂ�B
���{�̓f�W�^���ېłŔN��7�����[�����x�̐Ŏ���������ł���B
�@
�O�[�O����t�F�C�X�u�b�N�ȂǕ�IT���͕����I�Ȏ{�݂��������ɁA�f�[�^�̂��Ƃ�Ȃǂʼn҂��B���݁A�I�t�B�X��H��Ȃǂ́u�P�v�I�{�݁v(Permanent
Establishment ) ���Ȃ��ƊO���@�l�ɂ͖@�l�ł������ۂ����Ƃ��ł��Ȃ�
�B
���̂��߁A���B����{�ł͂����e�Ђ̐ŕ��S���ɒ[�ɒႢ�B
���B�ψ���͍�N3��21���A�f�W�^������ɂ�����ېłɊւ���w�߈Ă\�����B
���̌�AEU�ł͎b��I�Ȑł̓K�p�ɂ��āA�c�_��i�߂Ă������A�Ő��̕ύX�ɂ͑S���v�̏��F���K�v�ƂȂ�B
EU�̃f�W�^���ېňĂɂ́A��ŗ��ŕ�IT���Ȃǂ�U�v���Ă����A�C�������h�Ȃǂ������ɖҔ������A�܂��č�����́u�v���x������h�C�c�Ȃǂ��A���ۓI�ȉېŃ��[���������̋c�_�����ɂ߂�ׂ����Ƒ��������ɐT�d�Ȏp����������A��������q�����B
�t�����X��@��7��11���ADigital Services Tax�@�������AMacron
�哝�̂�7��24���ɂ���ɏ����A���ꂪ�@���ƂȂ����B
�ېŎ��� (i ) ���[�U�[�����̃��[�U�[�ƃR���^�N�g������A���i��T�[�r�X���w������f�W�^���C���^�[�t�F�[�X�̋��^
ii )
�t�����X�̃��[�U�[�ɍL������Ǝ҂Ƀf�W�^���C���^�[�t�F�[�X�ŃT�[�r�X�����^
�ېőΏۊ��
�ېŎ��Ƃ̑S���E���オ750�S�����[���ȏ�ŁA
�ŗ� �Ώ۔��㍂��3%
�ېŊJ�n 2019/1/1�ɑk�y
�Ēʏ���\���iUSTR�j��12��2���A�t�����X�����������f�W�^���T�[�r�X�ł��č���IT��Ƃ�s���ɍ��ʂ��Ă���ƒf�肵�A24���h�����ɑ�������t�����X��63�i�ڂɍő�100%�̐��يł���������B
2019/12/5�@�āA���f�W�^���łɐ��يŌ��� �@
�č��̓C�^���A�ɑ��Ă��[�u����������Ă���B
�o�ϋ��͊J���@�\�iOECD�j���f�W�^���ېłɂ��Ă̍��ۓI�ȃ��[������i�߂Ă���A2020�N1���܂ł̑�g���ӂ�ڎw���Ă���
���A���j���[�V���č���������12����{�AOECD�̃O���A���������Ɂu�č��͓Ǝ��̃f�W�^���ېłɋ���������B�Ċ�Ɗ����ɍ��ʓI�ȉe�����y�ڂ��v�Ƃ̏��Ȃ𑗕t�����B�č��̔��ŋ��c�͓�q����\���������B
�[�[�[
���̓����ɑ��A�A�}�]����O�[�O���͓��{�Ŗ@�l�ł��x�����悤�ɕύX�����B
�A�}�]���͓��{�@�l��2017�N12������2018�N12�����ɁA���ꂼ���150���~�̖@�l�ł�[�t�����Ƃ����B
�]���́A�č��{�Ђ����{�̋Ǝ҂���w���A���{�̎��v�Ƃɔ̔�����`���Ƃ��Ă����B�������v�͓��{�Ŕ�ېłƂȂ�B
���i�̑q�ɂւ̎���A���v�Ƃւ̔z���͓��{�q��Ђ�������A����������������Ƃ��āA���z�̐ŋ���[�����Ă����B
���݂́A���{�@�l���w���A�̔�����`�ɕύX�A�������v�͉ېőΏۂƂȂ����B
�A�ȑO�͓��{�̎��Ƃ̑唼�̓V���K�|�[���@�l���_�A���{�ȊO�Ŕ���グ���v�サ�Ă����B
�[�[�[
����A�C�^���A��2020�N�̗\�Z�Ă��c��ʼn����ꂽ�̂́A�傫�Ȑi�W�ł���B���@�ł͗\�Z�Ă����{�̐M�C�ĂƂ̈�̈ĂƂ��Ē�o����A�����ꂽ�B
��N6���ɔ��������C�^���A�́u�܂��^���v�Ɓu�����v�̘A�������́A�^�}�́u�����v�����t�s�M�C�Ă��o���A����̊�@�ɕm�����B
2019/8/13�@�C�^���A�A�������A����̊�@ �@
�������h�u����}�iPD�j�v�ƃ|�s�����X�g�i��O�}����`�ҁj���}�u�܂��^���v��8��28���A�V���ȘA���������������邱�Ƃō��ӂ����B
�R���e��9��4���A�u�܂��^���v�Ɓu����}�v��2�}�A���ɂ��g�t������}�b�^���b���哝�̂ɒ�o�A9��5���ɐV�t���̏A�C�鐾�����s�����B
���}�͐��ӂŁAEU�Ƃ̘A�g��ł��o�����B�A�������́A�������I�����J�����2023�N�܂ő������ƂƂȂ�B
����̗\�Z�Ẳ��͗��}�̘A���̌��ʂł���B��@�ł͊���12��16���ɏ��F����Ă���A�@�Ƃ��Đ��������B
��ȃ|�C���g�F
�����Ԏ��ڕW�@GDP��2.2%�@
�����Ԏ����ɂ��Ắ@2019/5/10�@�C�^���A��2019�N�x���ʂ��A���팸�̑�EU���B��
EU�̍����K���̊�{�́A�����Ԏ��̑�GDP��
3%�����A���I���c���̑�GDP�䗦 60%�����ł���B �i���I���c���͑����̍�������Ă���B�j
�C�^���A�̌��I���c����2018�N��134.8%����A2019�N�ɂ�135.7%�ɃA�b�v���錩���݂ŁA2019�N3Q�̃C�^���A��GDP��+0.1%�ɉ߂��Ȃ��B
�t�����l�ŁiVAT) �����グ�����B�@230�����[���̍Γ����A2021�N�ɑ啝�����グ���K�v�ƂȂ�B
���B�ψ���͕t�����l�ł�2020�N�ɗ\��ʂ�Ђ������A�����K�����ێ�����悤�����������͐T�d�ŁA�u�ʂ̐Ŏ��m�ۂ̕��@���l�������v�Ƃ��Ă���B
2018�N�\�Z���艻�@�Ă�2019�N1������̑��ł���߂��Ă������A2019�N�\�Z�@�ɂ����đ��Ŏ����͐摗�肳��A2020�N������{����ƒ�߂Ă���B
�����̐ŗ��̕ύX�ā@�@�Ԏ� �͓���
�@
���� 2019/1/1 2020/1/1 2021/1/1
�W���ŗ�
22%
24.2%
24.9% 25%
�y���ŗ�
10%
11.5%
13% �@
�v���X�`�b�N��
2020�N�\�Z�Ăɂ́A�v���X�`�b�N���i�i�{�g���A�|���܁A�g���C�A��ܗe�퓙�X�j��1kg������1���[���̐ł��ۂ��Ă��܂܂ꂽ�B
�ŏI�I��1kg������45�Z���g�ɏC�����ꂽ�B
�@
2019/12/30�@�؍��̌��錴��1���@�A�悤�₭�i�v��~����@
�؍��̌��錴��1���@�̂��i�v��~���悤�₭�����Ɍ��肵���B���q�͈��S�ψ����12��24���A�؍����͌��q�͂�2019�N2��28���ɐ\���������錴��1���@�̉i�v��~�^�c�ύX�Ă��^��5�A����2�ŏ��F�����B
���錴��1���@�͌×�����1���@�ɑ����A������2�Ԗڂ̉i�v��~�����ƂȂ�B
�[�[�[
���錴��1���@�i67.9��kW�j��CANDU������1983�N4��22���ɉғ��������A2012�N�ɑ�P���^�c�����Ԃ��I�������B�j �𓊓����Đݔ�����������ȂLj��S��������������A �̏��F����2022�N�܂ł̉����ғ��ɓ������B
����ɑ��A�ߗׂ̏Z����2100�l�]�肪�^�]�����͖������Ƃ��Ĉ��S�ς�ɍs���i�ׂ��N�������B
��R�̃\�E���s���ٔ�����2017�N2��7���A�������̎咣��F�߉����������������������n�����B�����R���̉ߒ��Ō��q�͈��S�Ɋւ���@�߂����߂鏑�ނ��s�����Ă������Ƃ�A�K�Ȍ��ق��s���Ȃ��������ƂȂǂ��w�E�A���q�͈��S�ψ��̂����A�ψ��̎��i���Ȃ��ɂ�������炸�R���ɎQ�����Ă����l�����������Ƃ���莋�����B
�؍����͌��q�͍͂T�i�����B
�������A �ĉғ��̕��j�͐����Ƌ��ɕς�����B
���ݓБ哝�̂͑I���^�����Ɂu�V�K�̌������݂�S�ʒ��f���A���v��𔒎�������v�ƌ������A�V���̂��̂���A���ݒ��̂��̂͌������A����40�N�Ō����ɗ���Ȃ��G�l���M�[����ɐ�ւ���Əq�ׂ��B
�哝�̑I���O��2017�N4��14���A�E�����s���c��6�c�̂Ɣ������ɂ��Ă̐���������A����1���ɂ��ẮA�u�����d���A���������ٔ��̍T�i����艺���A�P���@���ɕ�����v�Ƃ����B
�哝�̂�2017�N6���Ɂu����P���@���y�I����������v�Əq�ׂ��B
2017/6/1
�؍��A���ݗ\��̌����̐v�𒆒f�A�V�哝�̂̒E�������j�̈��
������ �؍����͌��q�͂� ������͑����������肵���B���S���ł͂Ȃ��o�ϐ��ɖ�肪����Ƃ������R
�ł�����
�������A���ꂪ���ƂȂ����B7,000���E�I���𓊓������̂ɁA�ғ�����50%��ɉ����āu�o�ϐ����Ȃ��v�ƌ��_�t�����B�������J�Â�O���ɒʒm���A�o�ϐ��͂�����̓I�Ȍv�Z���������Ȃ������B�u�����ς炢������v�Ƃ����ᔻ���o
���B
���̌�A�؍����q�͈��S�Z�p�@�͌��錴��1���@�̌�����i�߁A���S���ɖ�肪�Ȃ��Ƃ̐R�����ʂ����q�͈��S�ςɒ�o�����B
�؍����͌��q�� �͕��������ʂ��A2019�N2���ɂ͈��S�ψ���ɉi�v��~�̐\���i�^�c�ύX���\���j���o�����B
����ł����Ɣ��f���A�u�؍����͌��q�͌���P���@�������̌���̑Ó��� ����ї�������w�C�s�� �v�Ɋւ���č��@�̊č��v���Ă�{��c�ŋc�������B�č��@�͊Ԃ��Ȃ��č����J�n����B
�������A���q�͈��S�ψ���͍���A�]�����s���A��C�ψ�2�l���i�v��~�ɔ��������A��C�ψ�2�l�Ɣ��C�ψ�3�l���^����\�������B
�ψ����́u����܂Ŗ��ɂȂ��Ă����؍����͌��q��
�@
�Ȋw�Z�p�E�̏d��13�l��12��19���A���哝�̂ɑ��A�E�����G�l���M�[����̑S�ʓP��𑣂��ƂƂ��ɁA�����㌴�����f��APR-1400�����������A�o���邽�߂�
�A���ݕۗ����Ă���V�n���E��( �U��) ����3�A4���@�̌��݂��ĊJ����悤�����B
�@
�@ �^�]�J�n ���q�F�`�� �e�� �哝�̂̐���
�n���E�� �U��)
1
1988 /9 /10
�����y���F (PWR)
95��
�@
2
1989 / 9 / 30
�����y���F (PWR)
95��
�@
3
1998 / 8 / 11
�����y���F (PWR)
100��
�@
4
1999 / 12 / 31
�����y���F (PWR)
100��
�@
5
2004 / 7 / 29
�����y���F (PWR)
100��
�@
6
2005 / 4 / 22
�����y���F (PWR)
100��
�@
�V�n���E��
1
(2018/4)
KSNP (APR-1400)
140��
���݂��b��I�ɒ��~���A�Љ�I���ӂ�ʂ��ĉ^�]�̐��������
2
(2019/2)
KSNP (APR-1400)
140��
3
�@
KSNP (APR-1400)
140��
�����������B
4
�@
KSNP (APR-1400)
140��
�n���s�b
(���)
1
1986 / 8 / 25
�����y���F(PWR)
95��
�@
2
1987 / 6 / 10
�����y���F(PWR)
95��
�@
3
1995 /12
�����y���F(SYSTEM80)
100��
�@
4
1996 /3
�����y���F(SYSTEM80)
100��
�@
5
2002 / 5 / 21
KSNP(OPR-1000)
100��
�@
6
2002 / 12 / 24
KSNP(OPR-1000)
100��
�@
����
1
1983 / 4 / 22
CANDU
67.9��
�^�]���������������̍T�i����艺���A���������
2
1997 / 7 / 1
CANDU
70��
�@
3
1998 / 7 / 1
CANDU
70��
�@
4
1999 / 10 / 1
CANDU
70��
�@
�V����
1
2012 / 7 / 31
KSNP(OPR-1000)
100��
�@
2
2015/7
KSNP(OPR-1000)
100��
�@
3 �@
KSNP(OPR-1000)
100�� �i���F�j
4 �@
KSNP(OPR-1000)
100��
��
1
1978 / 4
�������^(PWR)
58.7��
�i2017�N6����~�����肵�Ă���B�j
2
1983 / 7
�������^(PWR)
65��
�@
3
1985 / 9
�������^(PWR)
95 �� �@
4
1986 / 4
�������^(PWR)
95��
�@
�V��
1
2011 / 2
�������^(PWR)
100��
�@
2
2012/7
�������^(PWR)
100��
�@
3
2017/1
�������^(PWR)
140��
�@
4
�Ԃ��Ȃ�
�������^(PWR)
140��
���݂��b��I�ɒ��~���A�Љ�I���ӂ�ʂ��ĉ^�]�̐��������
5
�@
�������^(PWR)
140��
�����������B
6
�@
�������^(PWR)
140��
�O�
4�� �@
�@
�@
�����ɖ߂��B
�m��
4�� �@
�@
�@
�@
�@
2019/12/31
�A�X�e���X����A�V���� CAR�זE�Ö@ �� Xyphos
Biosciences��
�A�X�e���X�����12��26���A�J���t�H���j�A�B��Xyphos Biosciences,
Inc.�̔��s�ςݑS�������擾�����B
2017�N�ݗ��ŁA ����Ɖu���ËZ�p�����p�������i�̌����J�����s���Ă���A�]�ƈ���7���B
�����葱��������1��2,000���h��
���x�������B ����ƁA�J���̐i���ɉ������}�C���X�g���x���������킹�A�ő�ő��z6��6,500���h�� ���x������
�B
Xyphos�Ђ��L����CAR�iChimeric
Antigen
Receptor�F�L�����R����e�́j�זE�Ö@�Ɋւ���Z�p�v���b�g�t�H�[���ł���ACCELTM �iAdvanced
Cellular Control through Engineered Ligands�j�ƂƂ��ɁA����Ɖu�̕�������[�h����D�G�Ȑl�ނ��l������
�B
CAR-T�זE���ẤA���җR���̖Ɖu�זE�iT�זE�j�̈�`�q�g�݊������s���A����זE�𑨂��čU�����₷��������Ŋ��҂̑̓��ɖ߂��Ɖu�זE��ÂŁA���Ö@���m�����Ă��Ȃ��d�āE�v���I�Ȏ����ɑ��鎡�Ö@�Ƃ��Ċ��҂���Ă���B
�č���2017�N8��30���A �Ĕ��E����ir/r�jB
�זE���}�������p�苅�������a�iALL�j�̏�������ю�N���l���҂�ΏۂƂ���CAR-T�Ö@��
CTL019�i���i�� Kymriah�j����FDA�̏��F���B
�����J������2019�N2��20���A�E�H�i�q���R�c��
�Đ���Ó����i�E�����R���Z�p������J�Â��A�m�o���e�B�X�t�@�[�}�́u�L�����A�_�H�Ò��v�i�`�T�Q�����N�����[�Z���j�� ��������CAR-T�זE��� �Ƃ����������F���邱�Ƃ𗹏������B2019�N3��26���ɏ��F
���擾�����B
CAR-T�זE�Ö@�ł͓��{�ł́A���O�����č�Gilead
Science�̑�זE�^B�זE�����p�� ��Ώۂɐ\���������ł���ق��A��ː����Z���W�[�����J�����s���Ă���B
2019/2/22�@���J�ȕ���A�������̈�`�q����2�i�ڂ̏��F�𗹏�
Xyphos�ГƎ���ACCELTM �Z�p�́A�^���p�N�H�w�ɂ��n��������e�̂ƃ��K���h�^���p�N�̓��ٓI�Ȍ����𗘗p�������������w�I��@�Ɋ�Â��Ă�
��B�Ɖu�זE�iconvertible CAR® �זE�j �ƁA�U���W�I�ł�������R����F������R�� �����K���h�^���p�N �ƗZ���������R��-���K���h�Z���^���p�N�iMicAbody�j �����҂ɓ��^���A���Â���Z�p
�B
���K���h�iligand�j�Ƃ́A����̎�e�́ireceptor�j�ɓ��ٓI�Ɍ������镨��
�U���ΏۂƂȂ邪��זE�̓����ɉ����āAMicAbody�����ւ�����A�����g�p���邱�ƂŁAconvertible CAR® �זE���قȂ邪��R���╡���̂���R����F�������A �l�X�Ȃ���זE���U�����邱�Ƃ��ł�
��B
�܂��AMicAbody�̓��^�ʂ߂��邱�ƂŁA�Ɖu�זE�ɂ��ߏ�ȖƉu�����𐧌䂵�A�]����CAR-T�Ö@�Ō�����T�C�g�J�C�����o�nj�Q�icytokine
release syndrome�j�̔�����}���ł��邱�Ƃ����҂����B
�T�C�g�J�C�� ���o�nj�Q �F CAR - T �Ö@���Ō����� �L�Q���� �̈�ŁA�ߏ�ȖƉu������ ��� ���ʂ̃T�C�g�J�C��
�i �זE���番�傳���ᕪ�q�̃^���p�N���j �����o���� �A�������T�C�g�J�C���Z�x�����x�ɏ㏸���邱�� �ɂ�� �N��
��B ���j �A �d�x�̒ጌ���A�p���A�ċz����Ȃ� �� �Ǐ}���ɐi�W����Ǝ��S�Ɏ��邱�Ƃ���
��B
����ɁAMicAbody�̍R�̕�����ʂ̃^���p�N�ɑւ��邱�Ƃɂ��Aconvertible CAR® �זE�̑��B���������\�ɂ�
��B
�@
Xyphos�Ђ�convertible CAR® -T�זE�̃��[�h�v���O�����͌��݁A�O�Տ��J���i�K�ɂ���A2021�N�ɏ��߂Ă̗Տ��������s����\��B
�A�X�e���X����ł́A���Ўq���Universal
Cells�Ђ��L���郆�j�o�[�T���h�i�[�זE�Z�p�Ƒg�ݍ��킹�A�������^�R���iHLA�j�s�K���ɂ�鋑���}�������\�����זE����convertible CAR® �זE���쐻���邱�ƂŁA�v�V�ICAR-�זE��Ð��i���n���ł���Ɗ��҂��Ă�
��B
�A�X�e���X�����2018�N2��14���A
�č��̃o�C�I�x���`���[�ł���Universal
Cells Inc. �������Ɣ��\�����B���j�o�[�T���h�i�[�זE�Z�p ��L���Ă���B
�Ǝ��ɊJ��������`�q�̕ҏW�Z�p ��p����HLA(���ȂƔȂ����ʂ��邱�Ƃ��ł����זE �̕\�ʍR��)�̔���������B rAAV(recombinant adeno-associated
virus)��p���ăq�g�̊��זE(ES�זE)�̈�`�q�ҏW���s�Ȃ������ʂƂ��āA�Ɖu���┽����Ƃ��זE���쐻�ł����B
�ڎ�
����