「ザイヤフレックス注射用」の供給継続を求める仮処分命令申し立ての却下について
当社は、本剤の安定供給が可能となる様、当該申し立て却下に対する抗告等を含め対応を検討しています。
| 2006年12月14日
旭化成ファーマ/クラレ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
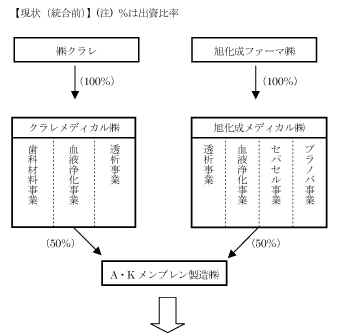
| 透析事業および血液浄化事業の統合について | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
旭化成ファーマ株式会社(本社:東京都千代田区 社長:大江 啓)の100%子会社の旭化成メディカル株式会社(本社:東京都千代田区 社長:吉田 安幸)と株式会社クラレ(本社:東京都千代田区 社長:和久井 康明)の100%子会社のクラレメディカル株式会社 (本社:東京都千代田区 社長:堀井 秀夫)は、両社の透析事業と血液浄化事業を統合することについて基本合意しましたのでお知らせします。 今後、公正取引委員会の事前相談を経て、詳細検討を進めていく予定です。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
日本経済新聞 2006/12/15
統合対象事業形態の一部変更に関するお知らせ
旭化成ファーマ株式会社(本社:東京都千代田区
社長:大江 啓)の100%子会社の旭化成メディカル株式会社(本社:東京都千代田区
社長:吉田
安幸)と株式会社クラレ(本社:東京都千代田区
社長:和久井 康明)の100%子会社のクラレメディカル株式会社
(本社:東京都千代田区 社長:堀井 秀夫)は、2006
年12 月14 日付の「透析事業および血液浄化事業の統合について」で発表のとおり、両社の透析事業と血液浄化事業を統合することについて基本合意し、本年10
月1 日の統合を目指して協議を重ねてまいりましたが、下記の通り本件の内容を一部変更することとしましたので、お知らせいたします。
1. 既発表内容の変更
(1)統合対象事業(本年10 月1 日時点)
(変更前)両社の透析事業と血液浄化事業の統合
(変更後)旭化成メディカル㈱の透析事業・血液浄化事業とクラレメディカル㈱
の透析事業の統合
(2)統合会社への出資比率
(変更前)旭化成ファーマ㈱ 85%、クラレメディカル㈱
15%
(変更後)旭化成ファーマ㈱ 93%、クラレメディカル㈱
7%
2.上記変更の理由
本件事業統合にあたり、公正取引委員会との事前協議を行っておりましたが、統合予定事業のうち血液浄化事業については、統合日程に間に合う期日までに、同委員会から国内市場での競争を制限するおそれがないとの回答を得られない見通しとなったため、透析事業のみの統合を先行させることとしました。また、出資比率の変更は、統合対象事業範囲の変更による事業価値評価の見直しによるものです。
3.統合スキーム
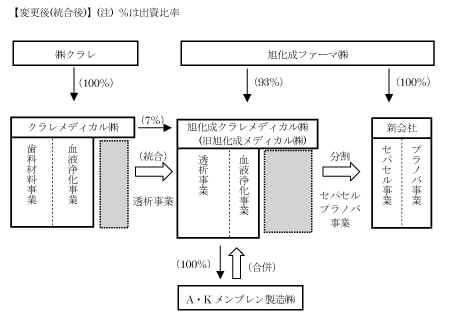
セパセル事業:輸血用白血球除去フィルター
プラノバ事業:ウイルス除去フィルター
いずれも当初から対象外
先進医療機器事業への新規参入について
~日本メドトロニックと戦略的な提携へ~
| 旭化成株式会社(本社:東京都千代田区、代表取締役社長:蛭田
史郎)は、このたび、日本メドトロニック株式会社(本社:東京都港区、代表取締役社長:島田
隆)が本年7月11日に薬事承認を取得した植込み型心電用データレコーダ「Reveal
DX」※1(リビールDX)の国内における独占的な販売権を取得することに合意し、先進医療機器※2事業に新規参入することとなりましたので、お知らせします。 両社では、今回の販売提携にとどまらず、他製品の提携についても継続して協議を進めていく予定です。 |
|||||||||||
| <ご参考> | |||||||||||
|
|||||||||||
メドトロニックは、世界初の電池式体外型心臓ペースメーカ開発者アール・バッケンにより1949年、米国ミネソタ州ミネアポリスで設立されました。Medtronic was founded in 1949 by Earl E. Bakken and the late Palmer J. Hermundslie.
医療機器の修理請負から医療機器の販売・修理へと事業を広げ、生体工学技術を応用した数々の先端医療技術を提供し、慢性疾患に苦しむ方々の健康回復とQOL(生活の質)の向上に貢献しています。
バッケンがペースメーカを世に送り出して半世紀を経た今、心臓疾患に始まったメドトロニックが提供する先端医療技術の対象はパーキンソン病、糖尿病、脊髄疾患、脳疾患、慢性的な痛みにまで及び、人々の健康回復への願いに貢献しています。
メドトロニックは世界120以上の国々で250を超える製造施設、営業所、研究施設、教育施設等を構え、38,000人が事業活動を行う世界屈指の国際医療機器企業です。医療機器の研究開発、製造、販売だけではなく、地域社会への福祉活動にも力を入れています。医療機器産業のリーディングカンパニーとして、今後も一人でも多くの慢性疾患に苦しむ方々に先端医療技術を提供していく努力をしていきます。
NxStage Medical
社との事業提携契約の締結について
旭化成クラレメディカル株式会社(本社:東京都千代田区、社長:吉田
安幸)とNxStage
Medical, Inc.(ネクステージ
メディカル社
本社:米国マサチューセッツ州ローレンス、社長:Jeffrey
H. Burbank)は、この度、透析事業領域(一部血液浄化(アフェレシス)事業関連を含む)に関し、包括的な事業提携契約を締結しましたので、お知らせします。
2.提携契約の骨子
(1) 中空糸供給
当社は、NxStage Medical
社に人工腎臓用ポリスルホン中空糸を供給します。NxStage
Medical 社はその中空糸を使用し、自社ブランドの人工腎臓をドイツ工場で製造し、北米にて販売します。
(2)人工腎臓組立
当社は、NxStage Medical
社ドイツ工場に当社ブランドの人工腎臓組立を委託し、生産された製品を北米を除く全世界で販売します。一定期間経過後、当社は、同工場の能力増強のための新規設備投資を実施し、新工場の土地、建物、設備等の所有権を保有します。
(3)ライセンス
NxStage Medical
社は、自社の人工腎臓設計と組立に関する特許およびノウハウについて、北米を除く世界市場を対象とした製造・販売権を当社に供与します。両社の技術融合による、その後の改良知的財産については、相互にクロスライセンスします。併せて、血液回路および関連製品についても、同様の条件にて、当社に販売権を供与します。
(4)資金提供
当社は、NxStage Medical 社に長期貸付金として4,000
万ドル(4 年満期)を提供します。
(5)その他コラボレーション
両社協議の結果、合意したコラボレーションテーマ(例えば、アフェレシス治療システム開発、次世代透析用装置システム開発等)について、両社共同で事業開発を行います。
<ご参考>
NxStage Medical 社の概要
社 名 : NxStage Medical, Inc.
本 社 : 米国マサチューセッツ州ローレンス
社 長 : Jeffrey H. Burbank
(ジェフリー・バーバンク)
売上高 : 約129 億円(2008 年度)
従業員数 : 約1,300 名
設 立 : 1998 年(2005 年米国NASDAQ に上場)
事業内容 :
在宅透析システム、急性腎不全治療システムの製造、販売、及び関連ディスポ製品事業
生産拠点 : ドイツ、メキシコ、イタリア
スイスActelion 社との訴訟における第一審判決について
旭化成の子会社である旭化成ファーマでは、旭化成ファーマが開発したRho-kinase 阻害剤である「ファスジル」のライセンス契約に関連して、スイス国Actelion社およびその関連会社・役員を被告とする損害賠償請求訴訟を米国において提起していましたが、このたび訴えが認められ、被告らに対して総額516.6 百万米国ドルの支払いを命ずる第一審判決が下されましたので、お知らせします。
On 04 May 2011 a jury awarded Asahi Kasei Pharma up to USD 547 million in compensatory damages (358.95 million in alleged lost profits and 187.4 million for alleged development costs). In addition, the jury awarded punitive damages of USD 30 million against certain individual officers of the company.Actelion Ltd. said on July 29 a California court reduced by $70.35 million the amount it was ordered to pay to Asahi Kasei Pharma Corp. over development of the lung drug fasudil. The court granted Actelion's request to offset some of the award ($78.4 million) with a previous arbitration payment, the Allschwil, Switzerland-based company said today in a statement.
1.経緯
旭化成ファーマは、CoTherix 社との間で「ファスジル」に関する開発・販売権を供与するライセンス契約を2006 年6 月に締結しました。2007 年1
月にActelion 社がCoTherix 社を買収し、それ以降CoTherix 社が「ファスジル」の開発を中止したため、2008 年11
月に旭化成ファーマは、Actelion
社およびその関連会社・役員に対して、被告らが不法に開発を止めさせたことを理由として損害賠償を求める訴えを米国カリフォルニア州サンマテオ郡地方裁判所に提起していました。
Asahi Kasei sued Actelion in 2008 claiming the company acquired CoTherix Inc. to halt work on fasudil and protect profits for its competing product, Tracleer. Before the acquisition, CoTherix was developing fasudil with Asahi Kasei.
なお、CoTherix 社に対しては、ライセンス契約の違反に基づく損害賠償を求めて国際商工会議所(ICC)において仲裁手続を行い、2009 年12 月、約91百万米国ドルの支払いをCoTherix 社に命ずる裁定を得て、旭化成ファーマが既に全額を受領しています。
2009/12/26 旭化成ファーマ、ライセンス契約違反の仲裁裁定で91百万ドル受領へ
Actelion 社の概要
1997 年に設立されたスイス国バーゼルに本社を置く製薬企業(2010 年度連結売上高1,929百万スイスフラン)。主力製品は、肺高血圧治療薬の「トラクリア」。
Rho-kinase
Rho-kinase
は、細胞内情報伝達に関与するリン酸化酵素で、血管平滑筋の収縮・弛緩をコントロールする生体機能分子として、近年、注目を集めている。血管平滑筋に存在するRho-kinase
が異常に活性化されると、血管平滑筋の収縮が亢進され、その結果生じる血流障害により組織の機能異常が起こる。Rho-kinase
阻害剤である「ファスジル」は、血管平滑筋の収縮を抑制するとともに、付随しておこる組織障害を効果的に改善することができる。
ーーー
2006年6月29日 旭化成ファーマ
ファスジル経口剤及び吸入剤のライセンス契約締結について
旭化成ファーマは、当社が開発した「ファスジル」について、このたび下記の通り米国のコセリックス社 (CoTherix,
Inc.)と経口剤および吸入剤に関するライセンス契約を締結しましたので お知らせ致します。
1.背 景
当社が開発した「ファスジル」は、新しい作用機序 (Rho-kinase
阻害作用)をもつ薬剤です。近年、Rho-kinaseの機能についての解明が進むにつれて、 多くの疾患に対してファスジルが効果を示すことが期待されております。
既に当社はファスジルを注射剤(商品名「エリル
注S」)として、国内において「くも膜下出血術後の脳血管攣縮及びこれに伴う脳虚血症状の改善」の適応症で販売しており、同疾患において広く使用されています。また、注射剤については、国内で脳梗塞の治療薬としての開発を進めております。
経口剤については、米国での狭心症を対象とした用量探索臨床試験が終了し、ファスジルの特徴が確認されております。また、その作用機序から肺高血圧症にも効果が期待されることもあり、当該治療領域に米国で経験のあるコセリックス社に導出することとなりました。
2.内 容
(1) 対 象 品: ファスジルの経口剤および吸入剤
(2) 対 象 疾 患: 狭心症(経口剤)、肺高血圧症(経口剤、吸入剤)
(3) ライセンス先: 米国 コセリックス社
(4) ライセンスの地域: 北米及び欧州
(5) ライセンス一時金: 契約締結時一時金として8.75百万米ドル、以降開発のステージアップ等に応じて支払いを受ける。
≪ご参考≫
CoTherix社の概要
本 社: 米国 南サンフランシスコ市
社 長: Donald J. Santel
事業内容: 2000年に設立し、2004年にNASDAQに上場している。肺高血圧症薬Ventavisを2005年から販売している。
---
2002年8月20日
血管拡張剤 ファスジル注射剤のライセンス契約締結について
旭化成は、この度当社の持つファスジル注射剤について、下記の通りドイツのシエーリング社(Schering AG社)とライセンス契約を締結しましたのでお知らせ致します。
米国ZOLL Medical Corporationの買収について
旭化成は、本日、米国の救命救急医療機器大手であるZOLL
Medical Corporation(本社:米国マサチューセッツ州、CEO:Richard A.
Packer、米国NASDAQ上場:ZOLL、以下「ゾール・メディカル社」)と、当社の米国子会社による株式公開買付け(以下「本公開買付け」)およびそれに続く現金を対価とする合併(以下「本合併」)によりゾール・メディカル社を買収(以下「本買収」)することについて合意しましたので、お知らせいたします。
当社は、上記合意内容に基づき、米国で新たに設立した子会社を通じた本公開買付けおよび本合併により、ゾール・メディカル社の発行済普通株式の総数を総額約22.1億米ドル(1株あたり93米ドル)で取得します。本買収は友好的なものであり、当社およびゾール・メディカル社の両取締役会は本買収を既に承認しております。なお、本買収完了のためには、独占禁止法に基づく条件の充足その他一般的な前提条件を満たすことが必要となります。
1.ゾール・メディカル社買収の目的
(1)本買収の背景
当社は創業以来、時代の変化に応じ、その時々の社会的なニーズに応えることで持続的に成長を遂げてきた企業です。昨年スタートさせた中期経営計画「For
Tomorrow
2015」の中で、当社は21世紀の社会が求める新しい価値を「健康で快適な生活」「環境との共生」と考え、この価値の提供に貢献することをグループの方針として掲げています。この方針に適合した新しい事業を創出することを目的として、昨年4月にグループ総合力の結集と融合を目指す「これからプロジェクト」(環境・エネルギー、住・くらし、医療の3領域)を立ち上げ、これからの社会的ニーズに合致する成長型ポートフォリオの構築を進めています。
その一環として医療関連分野については、「For Tomorrow
2015」の中で、当社グループ経営を支える次世代の中核事業領域と位置付け、グローバルな成長戦略を推進しています。
(2)本買収に至った経緯
当社のヘルスケア事業は泌尿器・骨領域・血液疾患等の医薬事業および透析等の血液浄化関連、バイオプロセス関連の医療機器事業の2つの領域により構成されています。当社はこれらの事業に加え、新たに成長を牽引する事業基盤の構築を検討してきました。その検討の中で、「人びとのいのち」を救うために必要不可欠な医療であり、今後もグローバルに成長が期待できる領域としてクリティカルケア(救命救急医療)分野に絞り、参入の機会を模索してきました。
また、ゾール・メディカル社は生命蘇生技術をコアテクノロジーとした会社で、米国の体外除細動器市場では強固な事業基盤を保有しています。着用式除細動器「LifeVest」や体温マネージメント機器「Thermogard」等の革新的医療機器で事業拡大を図るとともに、その基盤を欧州、アジアに拡げることを重要な方針として掲げています。当社は、日本での事業強化を模索していたゾール・メディカル社との協業を開始し、第一弾として昨年8月より、AED(自動体外式除細動器)「ZOLL
AED
Plus」を当社グループが販売を始めるとともに、ゾール・メディカル社の日本における薬事コンサルタントおよびマーケティングを当社グループ企業が引き受ける等、幅広い協力関係を構築してきました。今般、今後の両社のさらなる協力関係の強化について協議してきました結果、今回当社とゾール・メディカル社との間で本買収の合意に至りました。
ゾールは、生命蘇生技術をコアテクノロジーとした会社で、米国の体外除細動器市場では強固な事業基盤を保有している。また着用式除細動器「ライフベスト」など成長力のある製品を複数持っており、2011年度の売上高は5億2370万ドル、営業利益は4820万ドルだった。旭化成は昨年8月からゾールのAED(自動体外式除細動器)を日本で販売するなど協力関係にあった。
ゾールは現在、北米を中心に事業を展開しているが、アジアや欧州への拡大を進めている。
(3)本買収の意義
本買収により、当社は以下のことが実現できると考えています。
・
当社は、これまで既存の医薬、医療機器事業を通じて、医療現場へのマーケティング力、製品開発力および薬事法等の規制や医療保険制度への対応力を培ってきました。これらの知見・リソース等を活かすことによってゾール・メディカル社の日本およびアジア事業拡大を加速することが可能であり、また同社の製品の競争力を強化することにも貢献できます。
・ 当社はゾール・メディカル社の救命救急医療のグローバルに強固な基盤を確保することによって、さらなる成長のための投資の機会を得ることが可能になります。
・ 当社の既存の医療機器事業との顧客情報の共有、共同マーケティング等により、グローバルな事業拡大や新たな疾患領域への対応の機会を得ることができます。
なお、当社は本買収以降、ゾール・メディカル社の成長戦略の実現および加速のために必要な資源投入を図ります。また、上記の付帯効果を着実に実現し、当社の将来の中核事業とするために、M&Aを含め積極的な戦略的投資を行います。当社は、救命救急医療分野での革新的医療技術の開発、普及に取り組み、国内外で医療施設のニーズ解決と患者様のQOL向上に貢献していきます。
2.本買収の概要
(1) 本公開買付け実施者 当社米国子会社の下に設立された買収目的子会社(以下「SPC」)
本買収のため、当社は、SPCを米国マサチューセッツ州に設立しました。本公開買付け終了後、SPCはゾール・メディカル社に吸収合併され、ゾール・メディカル社は当社の連結子会社となります。
(2) 本公開買付けの対象会社 ZOLL Medical Corporation
(3) 買付けを行う株券等の種類 普通株式
(4) 買付け価格 1株当たり93米ドル
(5) 買付けに要する資金 約22.1億米ドル(予定)
ゾール・メディカル社の発行済株式総数を買付け、オプション等その他証券に関する支払いを行うために要する金額を記載しています。
(6) 買付け期間
買付け期間はゾール・メディカル社との合意の日(米国東部時間2012年3月12日)から10営業日以内に開始され、開始後最短20営業日(土曜日、日曜日および米国における祝祭日は含まれない)で終了します。なお、合意内容に基づき、買付け条件が充足されない場合は、買付け期間の延長を実施する可能性があります。
(7) 下限応募株式数
SPCは、ゾール・メディカル社の発行済株式総数の3分の2以上(完全希薄化ベース)の応募があった場合に買付けを行います。
(8) 本公開買付けによるゾール・メディカル社株式の保有割合の異動
本公開買付け前の保有割合 0%
本公開買付けおよび本合併後の保有割合 100%
3.ゾール・メディカル社の概要
(1) 会社名 ZOLL Medical Corporation
(2)設立 1980年
(3)所在地 米国 マサチューセッツ州
(4)Chief Executive Officer Richard A. Packer
(5)売上高 523.7百万米ドル(2011年度)
(6)営業利益 48.2百万米ドル(2011年度)
(7)従業員数 1,908名(2011年10月2日時点)
(8)主な拠点 米国、ドイツ
1952
While Chief of the Cardiac Clinic at Beth Israel Hospital, Paul M. Zoll, M.D., demonstrates that external electrical stimulation of a patient’s chest during cardiac arrest could produce an effective heartbeat.1980
ZOLL is incorporated by the company’s three co-founders, Dr. Zoll, Willard M. Bright, and Rolf Stutz.
旭化成の子会社であるZOLL Medical Corporationは、中枢性睡眠時無呼吸症(Central Sleep Apnea、「CSA」)に対する植え込み型神経刺激デバイス「remedē® System」の製造・販売を行う米国の医療機器メーカーRespicardia, Inc.(本社:米国ミネソタ州)を買収することを決定し、その手続きを4月9日(米国東部時間)に完了しましたのでお知らせいたします。1. 本買収の目的
ZOLL社は、医療機関向け除細動器および自動体外式除細動器(AED)、着用型自動除細動器「LifeVest®」等の心肺蘇生を中心とした既存事業※1に加え、心不全や呼吸機能障害といった心肺蘇生の周辺領域を取り込むことにより、クリティカルケア事業のさらなる拡大を目指しています。
Respicardia社はアンメット・メディカル・ニーズの高い疾患に対して革新的な治療法を提供しています。今回の買収により、ZOLL社の持つ心臓および呼吸器治療に対する専門知識とRespicardia社の医療機器を組み合わせることで、より多くの患者さんの命とQOL(Quality of Life)の向上に貢献できると考えています。2. Respicardia社の「remedē® System」について
Respicardia社の「remedē® System」は、中等度および重度の成人CSA患者に対する世界で唯一の植え込み型神経刺激デバイスとして米国食品医薬品局(FDA)から2017年10月に承認※2を受けた医療機器です。
睡眠時無呼吸症は主に閉塞性(Obstructive Sleep Apnea)と中枢性(CSA)に分類され、閉塞性は気道の物理的な閉塞が原因となりますが、中枢性は脳内の呼吸中枢が正常に機能しないことが原因で、呼吸が障害されるものです。CSAの症状には、慢性疲労、日中の過度の眠気、認知障害、睡眠障害等があります。また、CSAは心臓病(特に心不全)患者に併発しやすいことが知られており※3、入院や死亡リスクも上昇させると報告されています※4、5。
本機器は、胸部の横隔神経の一つに電気パルスを送ることで、呼吸を制御する筋肉(横隔膜)に信号が送られ、睡眠時における呼吸パターンを正常に戻します。「remedē® System」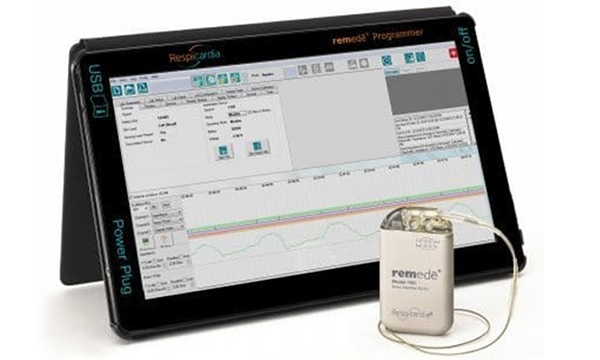
3. 今後の展望
ZOLL社は、Respicardia社の買収により、両社の販売網を活かした営業活動や心臓専門医へのアプローチ等のシナジーを最大限に活かし、米国において少なくとも100万人以上と推定される※6「remedē® System」の対象患者の睡眠改善や症状の緩和に努めていきます。 今後は、急性心筋梗塞や心不全、および呼吸機能障害等の疾患に対する製品・サービスをターゲットとした戦略的投資や買収を通して、これらの疾患に対するポートフォリオの拡大・強化を目指します。
旭化成グループは、持続可能な社会の実現を目指し、人びとの“いのち”と“くらし”に貢献し続けてまいります。
Respicardia, Inc.の概要
- 設立 2006年
- 所在地 米国ミネソタ州 ミネトンカ市
- 事業内容 「remedē® System」の開発・製造・販売
- 従業員数 約75名
- 主要な事業拠点 米国
ZOLL Medical Corporationによるイスラエル医療機器メーカーItamar Medical Ltd.の買収について
Respicardia社買収による植え込み型神経刺激デバイスの取得に続き、睡眠時無呼吸症の領域における在宅検査・診断ソリューションを獲得、心臓病患者へのサービスを強化
旭化成の子会社であるZOLL Medical Corporationは、心臓病患者への医療に睡眠時無呼吸症の診断を加えることにフォーカスした、医療機器およびデジタルヘルスのリーディングカンパニーであるItamar Medical Ltd.(本社:イスラエル・カイザリア)とItamar社の全ての発行済み普通株式を総額約538百万米ドル(約592億円)で取得する最終合意書を締結したことをお知らせします。1. 本買収の背景
ZOLL社は、医療機関向け除細動器および自動体外式除細動器(AED)、着用型自動除細動器「LifeVest®」等の心肺蘇生を中心とした既存事業に加え、心不全や呼吸機能障害といった心肺蘇生の周辺領域を取り込むことにより、クリティカルケア事業のさらなる拡大を目指しています。
睡眠時無呼吸症(Sleep Apnea)は主に閉塞性睡眠時無呼吸症(Obstructive Sleep Apnea、「OSA」)と中枢性睡眠時無呼吸症(Central Sleep Apnea、「CSA」)に分類され、OSAは気道の物理的な閉塞が原因となりますが、CSAは脳内の呼吸中枢が正常に機能しないことが原因で、呼吸が障害されるものです。心血管疾患とOSAおよびCSAとの間には、複雑な相互関係があることが示されており、OSAは、冠動脈疾患、心不全、脳卒中、心房細動の発症および進行の増加と関連し、一方、チェーン・ストークス呼吸を伴うCSAは、心不全や心房細動の発症を予測し、心不全患者の死亡リスクを強く予測する因子であることが報告されています。※2
ZOLL社は本年4月、CSAに対する植え込み型神経刺激デバイス「remedē® System」の製造・販売を行う米国の医療機器メーカーRespicardia, Inc.を買収しており、この領域への展開を進めています。
2. Itamar社の概要
Itamar社は、呼吸器系睡眠障害の検査・診断を支援する非侵襲的な医療機器およびソリューションの開発と販売における主導的地位を確立しております。同社は、患者と医療従事者のための革新的な睡眠時無呼吸症診断プログラムを開発しました。本製品はFDA(米国食品医薬品局)の認可を受けており、自宅でできる安全で効果的な睡眠時無呼吸症の検査方法として使用されています。
Itamar Medical Ltd.の概要
- 設立 1997年
- 本社 イスラエル・カイザリア
事業内容 睡眠時無呼吸症診断製品群等の開発・製造・販売
- 従業員数 約280名
3. 本買収の目的
ZOLL社のCEOであるJonathan Rennertは次のように述べています。「ZOLL社は、深刻な心肺疾患に苦しみ、十分な治療を受けられていない患者さんの転帰を改善することに尽力しています。現在、心血管疾患患者の60%が何らかの睡眠時無呼吸症を患っており、これらの患者さんの大部分が診断されていない状態と推定されています。※3 Itamar社が加わることで、より多くの患者さんに睡眠呼吸障害の診断と治療を提供できるようになることを期待しています。私たちは、心臓と睡眠の医療の世界の連携強化に貢献できることを楽しみにしています。」
Itamar社のPresident and CEOであるGilad Glickは次のように述べています。「循環器内科医とその患者さんのニーズに応えるリーダーであるZOLL社とともに活動できることをうれしく思います。Itamar社のテクノロジーと睡眠時無呼吸症向けのデジタルヘルスソリューションがZOLL社に統合されることで、未診断および未治療の患者さんのために在宅睡眠医療を推進するという我々の使命が加速されます。」
4. 今後の流れ
ZOLL社によるItamar社の買収は、Itamar社の株主による承認、規制当局による承認、その他の通常の取引完了条件を前提としています。一般的な規制当局や株主の承認期間を想定した場合、本買収は2021年末までに完了すると見込んでいます。
買収が完了した後も、Itamar社の主要事業は、イスラエル・カイザリアにある現在の拠点において、研究開発センター、デジタルヘルス技術センター、生産センターを含め継続される予定です。
米国SPI Pharma, Inc.社との医薬品添加剤における事業提携について
旭化成ケミカルズは、添加剤事業の強化拡大を図るため、医薬品添加剤他の製造販売を行う米国SPI Pharma, Inc. との間で医薬品添加剤における事業提携に合意し、日本と北米において2016年1月より両社の製品を相互に販売していくことを決定しましたので、お知らせします。
1.背景
一方、SPI社は、OD錠に適した賦形剤で崩壊性や服用感に優れたマンニトール※3「Mannogem(マンノジェム)」や口腔内崩壊錠用プレミックス製剤である「Pharmaburst(ファーマバースト)」等の製品を有しており、欧米を中心に幅広く事業を展開しています。
両社は、今後、相互の高機能品、販売チャネル等を補完し合うことで、さらなるグローバル展開が可能になると判断し、事業提携に至りました。
2.日本と北米での相互販売
3.将来の展望
4.SPI社概要
| (1)名称 | : | SPI Pharma, Inc. |
|---|---|---|
| (2)本社所在地 | : | 米国デラウェア州ウィルミントン市 |
| (3)代表者 | : | Rana Kayal |
| (4)事業内容 | : | 医薬品(制酸剤など)、医薬品・健康食品向け添加剤の製造、販売 |
| (5)出資 | : | Associated British Foods plc(100%) |
| (6)事業拠点 | : | 米国、フランス、インド |
当社は、本剤の安定供給が可能となる様、当該申し立て却下に対する抗告等を含め対応を検討しています。
----------------
2019年10月1日 旭化成ファーマ
「ザイヤフレックス 注射用」の供給継続を求める仮処分命令を請求する訴えの提起について
旭化成ファーマは、米国東部時間9月30日に、Endo Ventures Limited及びEndo Pharmaceuticals, Inc.他に対してデュピュイトラン拘縮治療剤「ザイヤフレックス 注射用」(一般名:コラゲナーゼ(クロストリジウム ヒストリチクム))の供給継続を求める仮処分命令を請求する訴えの提起を米国ニューヨーク州南部地区連邦地方裁判所に行いましたので、お知らせします。当社はEndo社との間で長期供給契約を締結しており、Endo社は供給契約に基づき本剤を日本国内においては当社に対して独占的に供給する義務を負っています。これまで当社は供給契約に基づき、Endo社から本剤の供給を受けて日本国内において販売してまいりました。
しかし、今般、供給契約により本剤の供給義務を負うEndo社から以後当該義務を履行しないとの通告を受け、Endo社は当社に対して本剤の供給を拒絶しました。当社は本剤の供給継続に向けてEndo社と協議してまいりましたが、Endo社は意向を覆しておりません。裁判によりEndo社に対して当社へ本剤を継続的に供給するよう命じられなければ、日本国内における本剤の継続的な供給に支障を来す可能性が生じてきました。
当社は、引き続きデュピュイトラン拘縮に対して手術以外の「薬剤による治療」という選択肢を臨床現場へ提供するべく、国内における本剤の安定供給を今後も継続できるよう努力してまいります。
In
Under the agreement, Asahi Kasei Pharma was
granted the exclusive right to commercialize XIAFLEX® for the
treatment of Dupuytren's contracture and Peyronie's disease in
Asahi Kasei Pharma is also responsible for
clinical development and regulatory activities for XIAFLEX® and has a
right of first negotiation to obtain exclusive rights to commercialize other
XIAFLEX® pipeline indications in
---
Asahi Kasei has a long-term development, commercialization and supply agreement with Endo which requires Endo to exclusively supply the company with the pharmaceutical in Japan. Until now, Endo has supplied the drug to the Asahi Kasei which has been selling Xiaflex in Japan under the supply agreement.
However, Endo, which is currently obligated to supply the Pharmaceutical, notified the company that it will breach its obligations under the supply agreement and has refused to supply the drug to Asahi Kasei despite discussions.
The Company is making every effort to ensure a stable supply of the Pharmaceutical in Japan, in order to provide clinical practice with the option of medicinal treatment besides surgery for Dupuytren’s contracture.
Asahi Kasei obtained the received rights to develop and market Xiaflex in Japan through an agreement it signed with Auxilium in March 2011. Endo acquired Auxilium in 20015 in a deal valued at $2.6 billion.
Under the deal, Endo became eligible to receive up to $217 million in remaining potential milestone payments tied to Xiaflex being approved in Japan for other uses, and up to $210 million tied to the drug reaching undisclosed annual net sales thresholds.
2024 年7月 18 日 旭化成
Calliditas Therapeutics AB に対する株式公開買付け開始について
旭化成は、本年5月28日に開示しました「スウェーデン製薬企業Calliditas Therapeutics ABの買収について」でお伝えしましたとおり、腎疾患領域の治療薬Tarpeyo(タルペーヨ)を販売するCalliditas Therapeutics AB(本社:スウェーデン ストックホルム、CEO:Renée Aguiar-Lucanderの発行済普通株式の総数を1株当たり208スウェーデンクローナ(約3,114円)(注1)、米国預託証券は1株当たり416スウェーデンクローナで取得する公開買付け(以下「本公開買付け」)を、スウェーデン時間の2024年7月18日に開始いたしましたので、お知らせいたします。
本公開買付けの買付け期間は、2024年7月18日から2024年8月30日まで(スウェーデン時間)を予定しております。なお、買付け条件が充足されない場合は、買付け期間を延長する可能性がございます。また、本公開買付けの完了後速やかに、Calliditas社は当社の完全子会社となる予定です。
(注1)1 スウェーデンクローナ=14.97 円(7月 17 日付為替レート)で換算。
説明資料 https://www.asahi-kasei.com/jp/ir/library/business/pdf/240528.pdf
1. 当社は、 Calliditas Therapeutics
ABを株式公開買付けにより買収することを決定しました
2. Calliditas社は、米国医薬品市場の腎疾患領域にて強力なプレゼンスを有しており、今後も高い成長が見込まれています
3. 本買収における取得価額は約1,739億円です
2024年7月より株式公開買付けを開始し、9月中のクロージングを目指します
4. 本買収に伴うのれん等償却後の営業利益は2025年度に黒字化することを見込み、
上市済みの製剤は、 2030年度以降にピーク売上高5億米ドル超を見込んでいます
旭化成は、スウェーデンの製薬企業である Calliditas Therapeutics ABに対し、Calliditas社を買収することを目的に、当社による株式公開買付けを行うことを、本日開催の当社取締役会において決議しましたので、お知らせします。また、本公開買付けは同時に Calliditas 社の米国預託証券(ADS)の全ても対象となっており、本米国預託証券は 1 株当たり Calliditas 社の普通株式の 2 株に相当します。米国預託証券に対する公開買付けについては、米国証券法に則り本公開買付けと同時に実施予です。
Calliditas 社はナスダック・ストックホルム市場に上場しており、米国預託証券はナスダック・グローバル・セレクト市場に上場しております。当社は本公開買付けにより、Calliditas社の発行済普通株式の総数を 1 株当たり 208 スウェーデンクローナ(約 3,076 円)、米国預託証券は 1 株当たり 416 スウェーデンクローナで取得することを目指します。
本買収は友好的なものであり、当社取締役会は Calliditas 社の完全子会社化を目的とした本公開買付けを行うことを決議しており、Calliditas 社の取締役会についても本公開買付けを行うことに賛同しております。
また、BVF
Partners、Linc
AB、Stiftelsen
Industrifonden(Calliditas株式(米国預託証券を含む)の上位
3
株主)ならびにその他
Calliditas
社の大株主(合計で発行済普通株式および米国預託証券の
44.65%(注2)を保有)から本公開買付けに
1
株当たり
208
スウェーデンクローナで応募する旨の同意を得ております。当社は本公開買付けにより、Calliditas
社の発行済普通株式の総数を総額約
118
億スウェーデンクローナ(約1,739
億円)で取得することを目指します。なお、本買収完了のためには、国外の競争法令等及び投資規制法令等上の手続きの完了、ならびにその他一般的な前提条件を満たすことが必要になります。
(注1)1
スウェーデンクローナ=14.7906
円(5
月
27
日付為替レート)で換算。
Calliditas
社は医薬市場のアンメットニーズに応えるための治療法の研究・開発に注力しており、業界でも信用力の高い経営陣が牽引するスペシャリティ製薬会社です。Calliditas
社の主力製品である Tarpeyo(タルペーヨ)は、 疾患進行のリスクがある原発性 IgA
腎症の腎機能低下を抑制することで病状の進行を防ぐことが示された、現在当該疾患を対象として承認・販売されている唯一の医薬品であり、当社製品や開発パイプラインの事業領域や地域を補完する医薬品であると考えております。
当社は本買収を通じて、Calliditas
社が保有する事業資産や人財の活用によってポテンシャルを最大限に活かし、グローバルスペシャリティファーマとしての進化を加速できると考えております。
当社は、本買収により以下の実現を目指します。
• 米国での腎疾患および自己免疫疾患における販売体制の拡充により、米国市場でのプレゼンスを確立する
• 欧州でのプレゼンスを確立し、初期には研究開発活動に専念する
• グローバルスペシャリティファーマとしてのプラットフォームを活用し、新たな医薬品や開発パイプラインの導入機会を拡充する
公開買付けに要する資金総額約 118 億スウェーデンクローナ(約 1,739
億円、53,672,069 株を基準として計算)を予定しております。
Calliditas 社の株主、または米国預託証券の株主に対して払われる公開買付け価格総額の資金には、手元現金を充当する予定です。
-----
]