2003/01/14 エーザイ
米国子会社エーザイ・インク、MRを60%増員
エーザイ株式会社(本社:東京都、社長:内藤晴夫)の米国子会社エーザイ・インク(本社:ニュージャージー州、会長:松野聰一)は、本年MR(医薬情報担当者)を150名増員し、米国内の販売力を強化します。このたびの増員は今後2年間でMRを現在の250名から500名以上にする計画の一部です。
これらの増員により、「アリセプト」の主要な処方医に対する一層の訪宣活動の強化や、「アシフェックス」のPPI市場におけるシェア・オブ・ボイス*向上をはかります。また、より市場に密着した区割りでの営業組織の展開や、営業間接費の効率化が期待されます。
エーザイ・インクは、研究開発から生産、販売、プロモーション、物流に至る一貫した機能を有しています。2001年度に売上が10億ドルを越す企業に成長し、2006年度には20億ドル企業になることをめざしています。なお、同社はアルツハイマー型痴呆治療剤「アリセプト」およびプロトンポンプ阻害型抗潰瘍剤「アシフェックス」を、それぞれのパートナーであるファイザー社およびヤンセン社のプロモーション支援を受けて、自社販売しています。
*:MRによる医薬情報提供量のシェア
日本経済新聞 2003/1/15
米で医薬研究強化、エーザイ 販売担当者も倍増
エーザイは2006年までに米マサチューセッツ州に、あらゆる基礎研究業務に対応できる研究棟を約6500万ドル(約77億円)を投資して新設する。米国の販売担当者も来年末までに倍増する。日本の医薬品市場が低迷する中、世界最大市場の米国に積極投資し、研究開発から販売までの一貫体制を強化する。
日本経済新聞 2003/1/18
医薬原料 中国で生産委託 住商、日米欧企業を仲介
住友商事は中国で医薬品事業に参入する。日米欧の大手製薬会社から抗がん剤や心臓病用薬などの原料の注文を受け、中国の製薬企業に生産を委託する仲介会社を上海に設立した。世界の製薬会社の間で医薬品原料などをコストの安い中国から調達する動きが広がっているのに対応する。
住商グループの全額出資で仲介専門会社を設立した。資本金は200万ドル(約2億4千万円)。住商の中国現地法人の医薬部門の要員を新会社に移し、約20人の陣容でスタート。5年後に1億ドル(約120億円)の売り上げを目指す。
新会社は中国の有力な製薬会社約10社と協力し、日米欧の大手製薬会社が求める医薬品原料や製品に近い中間体をつくる体制を整える。中国に検査機関も設置し、品質管理にあたる。
欧米の大手製薬会社は経営資源を研究開発に集中するため、原料などの製造工程の外部委託(アウトソーシング)を進めている。昨年7月に成立した改正薬事法により、日本の製薬会社も製造工程を早ければ2005年から外部委託できるようになる。医薬品生産は検査や出荷工程、多品種少量品の生産切り替えなどに人手がかかる。このため人件費が安い中国への委託生産が増えると判断した。
中国では2004年にも外資による医薬品販売が自由化される見通しのため、新会社は中国国内で、外国の製薬会社の製品の販売準備も進める。
こうした中国の規制緩和をにらんで、三共など日本の大手製薬会社は現地に合弁工場や情報収集拠点の設置を進めだしている。住友商事は仲介やコンサルティング機能を前面に出し、日米欧の委託企業の要求にきめ細かくこたえる生産基盤を現地で整え、事業拡大を目指す。
日本経済新聞 2003/1/23 CRO:Contract
Research Organization
臨床試験の支援 アジア事業拡大
イーピーエスやシミックなど 高成長見込み人員増
臨床試験(治験)支援各社がアジア地域での事業を拡大している。国内や海外の製薬会社が市場成長力のある中国などで治験を行う例が増えているのに加え、安い人件費で従業員を雇用できるため。急成長した国内市場に続き、海外でも支援業務の受託をテコに新たな市場の開拓を図る。
イーピーエスの中国子会社、上海日新医薬発展公司は、日本の製薬会社が新薬販売後に安全性を確認する市販後調査のデータ収集や解析業務の受託を拡大する。2003年9月期の売上高は前期比71%増の7千万円、経常利益は9%増の600万円を見込む。
業務の拡大に合わせ、前期は9人だった従業員を21人に増やす。人件費が安いため、製薬会社にとっては業務委託費が少なくて済む。
シミックの韓国子会社、シミックコリアは欧米製薬会社の現地法人を中心に生活習慣病治療薬などの治験を受託し、2003年9月期の売上高を前期比約2倍の8千万円に伸ばす計画。中村和男社長は「韓国には外資系の製薬会社があまり進出しておらず、将来性がある」と強調する。 本社に韓国や東南アジア諸国での海外事業展開を企画する「グローバルリサーチオペレーションチーム」を設置。中国事務所のスタッフも3人から10人に増員する。
東京CRO(東京・千代田、西山利巳社長)は.2003年7月期中に中国、台湾、韓国への進出計画をまとめる。「中国市場は成長が見込める」(西山社長)として、進出に備え中国人医師を1人採用した。
アジア各国では日本や欧米の製薬会社が新薬販売のため治験を実施する例が増えているが、現
地には治験を支援する企業がほとんどないのが実情。製薬会社の進出を側面支援することで自らの海外事業の拡大を図る。
日本CRO協会 http://www.jcroa.gr.jp/
| CROって何ですか? | ||
| : | CROとは、英語のContract
Research Organizationの略語で、医薬品などの開発業務を製薬企業などから受託する開発業務受託機関(企業)を意味します。 欧米で1970年代から現れた業態で、現在では欧米の医薬品、医療用具、化粧品等の開発業務の数十パーセントをCROが受託しております。 |
|
| CROは日本でも認められているのですか? | ||
| 日本では、平成9年3月27日付け厚生省令第28号「医薬品の臨床試験の実施の基準に関する省令」、及び同9年5月29日付け薬審第445号/薬安第68号厚生省薬務局審査課長/同安全課長通知「医薬品の臨床試験の実施の基準の運用について」(併せていわゆる新GCP)で、「受託者」及び「開発業務受託機関」として法的な位置付けを与えられました。 現在、日本でCROと呼ばれる企業は約30社あります。 |
||
| では、CROは一体何をするのですか? | ||
| CROは、薬品、医療用具、化粧品などの開発業務の全部又は一部を製薬企業などから受託します。 全部は挙げられませんが、臨床試験や市販後調査などを実施する医療機関との関わりにおいて、CROは主に次のような業務を実施します。 |
||
| 1) | 臨床試験・市販後調査などのプロトコール・治験(調査)薬等概要書・症例報告書(調査票)書式の作成や、作成に際しての専門的アドバイス業務 | |
| 2) | 臨床試験・市販後調査などの実施医療機関の選定や、医療機関に対する治験(調査)依頼・治験(調査)契約締結に関する業務 | |
| 3) | 実施医療機関における、臨床試験・市販後調査などのモニタリング(調査)業務、治験(調査)薬の交付・管理・回収、症例報告書(調査票)の回収とチェック業務 | |
| 4) | 実施医療機関に対する治験(調査)終了・中止に関する業務 | |
| 5) | 症例検討などのデータマネジメント業務や、症例の統計解析業務 | |
| 6) | 治験総括報告書・投稿論文・安全性定期報告(案)などの作成や、作成に際しての専門的アドバイス業務 | |
| 7) | 治験(調査)監査業務 | |
| どうして製薬企業はCROに開発業務を委託するのですか? | ||
| 医薬品などの開発は、膨大な時間と労力、そして費用を必要としますが、国際的な競争も厳しい昨今、たくさんの開発品目を抱えた製薬企業等が、あらゆる品目において高度の知識と経験を有したモニターや開発要員を揃えるのは難しくなってきました。 そこで、CROは、製薬企業からの委託という形でその開発業務の一端をお手伝いし、経験と実績により蓄積した専門性を提供しています。 |
||
| 日本CRO協会って何ですか? | ||
| 日本CRO協会は、日本で業務を実施するCRO企業による任意の業界団体として1994年に設立され、1999年8月現在、17社が加盟しております。 本協会は、加盟各社が遵守すべき自主ガイドラインを制定し、自主勉強会や専門家による講演会の実施など、常にCRO業務の質の確保と向上を目指し研鑚を続けております。 また、多くの企業が国際的なパイプラインも持ち、21世紀における国際的な臨床試験のあり方も多角的に検討しています。 |
||
正会員 (平成14年11月1日現在 14社)
| : | IBRD JAPAN㈱ | http://www.mictokyo.co.jp/ibrd/ | |
| イーピーエス㈱ | http://www.eps.co.jp | ||
| ㈱ エスアールディ | http://www.cro-srd.co.jp | ||
| クインタイルズ・トランスナショナル・ジャパン㈱ | http://www.quintiles.co.jp/ | ||
| ㈱ 国際医薬品臨床開発研究所 | http://www.incrom.co.jp | ||
| ㈱ CRCソリューションズ | http://www.crc.co.jp/science/CRO/cro.html | ||
| シミック㈱ | http://www.cmic.co.jp/ | ||
| ㈱ 新日本科学 | http://www.snbl.co.jp | ||
| 東京CRO㈱ | http://www.cro.co.jp | ||
| ㈱ 日本アルトマーク(東京・大阪) | http://www.gn5.co.jp | ||
| パレクセル・インターナショナル㈱ | http://www.parexel.co.jp | ||
| ㈱ ベルシステム24 | http://www.bell24.co.jp | ||
| ㈱ メディサイエンス プラニング | http://www.mpi-cro.co.jp/ | ||
| ㈱ モス インスティテュート | http://www.moss.co.jp/ |
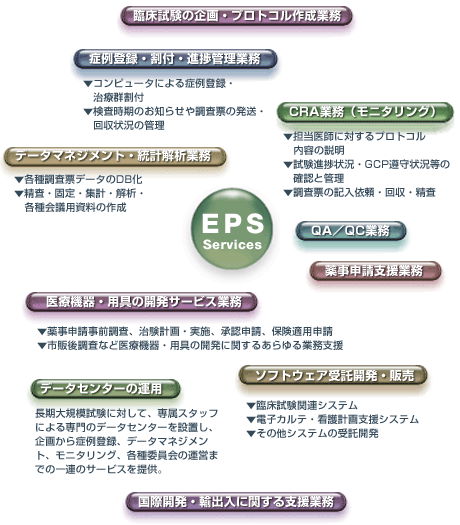
イーピーエス株式会社 The Clinical Service Provider http://www.eps.co.jp/
| 新薬開発に必要なクリニカルトライアルをアウトソーシングによって的確に、迅速に、客観的に行うための専門カンパニー(=CRO:Contract Research Organization)です。 | |||
| 代表者 | 代表取締役社長 厳 浩 | ||
| 設立 | 平成3年5月 | ||
| 資本金 | 6億1875万円 | ||
| 従業員 | 374名(2002年6月末日現在) | ||
| 本社 | 東京都文京区後楽2丁目3番地19号 秀和飯田橋ビル | ||
当社の全ての業務は、独自に定めた基本SOP「臨床試験受託業務における標準業務手順書」、そしてそれをベースとして受託業務ごとに作成されるSOP「作業手順書」に従って実施されています。さらに、それらSOPの遵守状況に関しては定期的に社内監査が実施され、必要に応じて改善の措置を講じます。「業務の品質を常に高く保つ」――それが私たちのポリシーです。
刻々と変化する臨床試験を取り巻く環境は、CROにも様々な新しい役割を求めています。私たちは既存業務を一層強化すると同時に、医療用具や前臨床試験への業務拡張、CRC(Clinical
Research Coordinator:治験コーディネーター)を中心としたSMO(Site
Management Organization:治験実施施設管理機関)業務の展開、海外のCRO/SMOとの提携などを通して、グローバルなフルサービス型CROへの体制作りを日々進めています。また、自社開発による試験管理システムの開発や、インターネットを利用した症例登録やデータ集積など、より高度な情報技術の活用を行っていきます。
シミック株式会社 http://www.cmic.co.jp/j/index.htm
シミックは1992年に日本で最初にCROというビジネスを開始致しました。それから10年近くが経過し、医療を取り巻く環境はめまぐるしい変化を続けています。製薬会社は世界規模での新薬開発競争の激化により、創薬から販売までを自社で行うスタイルから、分業・協業へと積極的にシフトしてきています。こうした中、私たちシミックは製薬会社のアウトソース先から臨床試験のプラットフォームとして医薬品開発を総合的にサポートするPVC(Pharmaceutical Value Creator)を目指し、戦略的に事業を拡大していきます。
| 本社所在地 | 東京都品川区東五反田4-7-20 相生ビル | ||
| 設立 | 1985年 | ||
| 資本金 | 1,216,060千円 | ||
| 業績 | 2002年9月期 売上(連結) 65億2,500万円 経常利益(連結) 6億5,600万円 |
||
| 代表者 | 代表取締役社長 中村和男 | ||
| 従業員数 | 716名 (連結決算子会社 計) (2002年10月末現在) | ||
| 連結決算子会社 | シミックCRC(株) (株)シミックMPSS (株)シミック-BS (株)シミックADC CMIC Korea Co., Ltd. |
提供サービス
臨床開発業務 QC業務 GCP監査業務 データマネジメント/統計解析業務
戦略・薬事コンサルティング業務 国際業務 メディカルライティング業務
臨床試験支援システム開発業務 市販後調査(PMS)業務 教育・研修
疫学業務 臨床開発人材派遣サービス
シミックCRC㈱業務
㈱シミック-BS業務
㈱シミックMPSS業務
㈱シミックADC業務
日本経済新聞夕刊 2004/3/8
日本の実力派たち シミック会長兼社長 中村和男さん(57)
新薬開発 プロデューサー走る
アドレナリンが出る思いがした。十数年前、出張で訪れた米国のバイオベンチヤー企業。若い研究者はトレーラーハウスに泊まり込んで実験に没頭している。同僚を励ましながら資金を集め、製品化への最短距離を駆け抜けるプロデューサーのような研究者もいた。「自分がやりたいのはこれだ」。帰国すると、辞表を出した。
会社はあわてふためいた。大ヒット商品の開発チームを三十代で率いた人物だったからだ。1989年発売の高脂血症治療薬「メバロチン」。発売から十年あまりで販売額は2兆円を超す。三共の屋台骨を支え続けた。
「黙っていれば役員になれたかもね」。だが、黙っていられなかった。
メバロチンは若手主体で開発し、臨床試験などの新機軸を次々に取り入れた。この成功体験を組織改革に生かそうとリポ-トにまとめて社内で回覧したら、上司との関係がギクシャクし始めた。年功序列や前例主義への批判ととられたようだ。皮肉にも、メバロチンの成功で潤った会社は改革の機運が薄らいでいた。
そんなときの米国出張。三共を飛び出し、日本初の医薬品の開発受託会社を始めた。新薬のタネになる化合物を製品化するため、安全性や効き目を詳細に調べる臨床試験を製薬会社から請け負う。多額の資金とスピードが要求される開発業務を支援するプロ集団だ。退職金や親からの借金で工面した2千万円を元手に45歳で旗揚げした会社は急成長。株式を上場するまでになった。
もともとねばり強い研究者ではなかった。薬学部に籍を置いた京都大学では、軽音楽部のマネジャーとして「百人の部員を食わせた」ことが誇り。資金をひねり出すため、洗車の出張サービスなど副業にも手を染めた。
権限委譲を進めている。「もう一度プロデューサーをやってみたい」との思いが再び強くなったからだ。
本社には米国の画家キース・ヘリングの作品が並ぶ。米国出張の際、立ち寄った画廊で一目ぼれした。「既存の概念を捨てよ、素直にものを見よと訴えかけてくる」。それがプロデューサーの心得だと思っている。
存在感高まる開発支援集団
新薬開発を外部委託する製薬会社が増え、開発業務を支援する事業は急成長が続く。臨床試験データの収集や解析に加え、進行状況の確認や医療施設支援など守備範囲も広がっている。
画期的な新薬の開発は患者と企業の双方に大きな恩恵をもたらす。時間と戦いながら、安全性の確保に万全を期す必要がある。存在感が高まるにつれ、社会的責務も重くなっている。
化学工業日報 2003/6/16
シミック、韓国でCRO事業が好調
国内CRO大手・シミックの韓国事業が順調に拡大している。同国内において、6月時点で進行中の受託プロジェクトは16本にのぼっている。さらに契約手続き中の案件が複数あることから、近く20本を超える見込みだ。国内CRO企業で韓国に拠点を持つのは同社のみ。1998年に現地拠点としてシミック・コリアを設立し、CRO業界が確立されていない同国で実績を積んできた。シミック・コリアの社員は約20人。顧客は欧米製薬企業の現地法人や韓国企業など。同国内で基盤を構築したことから、将来的には日本企業が韓国進出する際にも強力に支援事業を展開していくとみられる。
東京CRO株式会社 http://www.cro.co.jp/
| 設立 | 平成8年(1996年)10月16日 | ||
| 払込資本金 | 9,500万円 | ||
| 主要株主 | 西山利巳 ライフサイエンス出版株式会社 長谷川僚三 石本祐男 |
||
| 事業内容 | CRO (Contract Research Organization):開発業務受託事業 | ||
| 住所 | 〒101-0041
東京都千代田区神田須田町 2-6 ランディック神田ビル 6階 |
業務内容
| 受託業務1 Clinical Trials Support 臨床試験サポート・モニタリング | |
| : | 医薬品・医療用具等の有効性、安全性の評価のための臨床試験は、ヘルシンキ宣言及び新GCPに則り、倫理的配慮のもとに科学的かつ適正に実施されなければなりません。弊社では、社員の経験、ノウハウ及び人脈を最大限に活用し、貴社をサポートいたします。 |
| 受託業務2 Data Management | |
| 臨床試験において収集されたデータは、科学的に解析されなければなりません。 弊社においてはデータ解析の専門家による解析を行っております。 |
|
| 受託業務3 Consultation 薬事・医療コンサルティング及びプロジェクトコーディネーション | |
| 薬事法及び、プロジェクトコーディネーションに関する事項について貴社をコンサルトし、トータルマネジメントを的確に支援します。 弊社は、製薬・医療関連会社での開発経験者や薬事申請の経験者など様々なノウハウを持った社員を擁しておりますので、貴社の業務の軽減、及びアウトソーシングとしてご利用いただけます。 |
|
| 受託業務4 Quality Assuarance GLP,GMP,GPMSP等の整備・監査 | |
| GCP査察は、医薬品に加えて医療用具についても開始されております。このような基準に基ずく臨床試験、製造、輸入販売及び市販後調査を行うために、必要な助言、指導及び第三者監査を行います。 | |
| 受託業務5 Regulatory Affairs 薬事承認申請関連業務 | |
| 弊社では承認申請の経験豊かなスタッフが、申請書作成から保険適用申請まで貴社をバックアップいたします。 | |
| 受託業務6 In-Country Caretaker Service 国内管理人 | |
| 外国製造業者が日本国の承認を直接申請するに際して、国内管理人業務を承ります。 弊社では製造業者に代わって、申請から副作用・不具合等の報告まで国内管理人の業務の一切をお引き受けいたします。 |
|
| 受託業務7 Semminar Management 医薬品及びメディカル関連教育セミナーの開催等 | |
| 弊社では、医薬品・医療用具さらにメディカル関連やCROに関する、セミナー等を積極的に開催しております。 | |
日本経済新聞 2003/2/4
持田製薬が分社 医療用生産など3部門 発表
持田製薬は3日、医療機器とヘルスケア、医師の処方が必要な医療用医薬品生産の3部門を2005年4月までに分社化すると発表した。同社は利益の9割以上を医療用医薬品が占める。経営判断を迅速にできる体制にし採算向上につなげる。
医療機器部門は今年11月に、ヘルスケア部門は2004年4月に、医療用医薬品の生産部門は2005年4月に会社分割により分社化する。いずれも持田の全額出資子会社とし、持田本体は医療用薬の研究開発と販売を手掛ける。現在の社員数は全体で約1700人だが、うち計340人が新会社に移る見込み。
医療機器部門は超音波診断装置などを扱い、2001年度の連結売り上げは56億円、営業利益は1億3千万円。化粧品「コラージュ」シリーズなどを手掛けるヘルスケアの同期売り上げは33億円、営業利益は3億3千万円。
2003/2/3 持田製薬
医療機器・ヘルスケア・製造部門の分社(会社分割)について
持田製薬株式会社(社長:持田直幸)は、2月3日に開催された取締役会において、当社の医療機器、ヘルスケア、製造の各部門を別紙のとおり分社(会社分割)することを決議いたしましたのでお知らせいたします。
なお、本件に関する詳細は、今後の取締役会において決定のうえ株主総会に付議する予定であり、当該取締役会の決定後速やかにお知らせいたします。
1.分社(会社分割)の目的
各部門の主体性と責任を明確化し、事業環境・業態に応じた経営を可能とすることにより、各部門の収益力・競争力の向上、ひいては当社グループ全体の企業価値の最大化を図る。
別紙1:医療機器部門の分社(会社分割)について
| 1.会社分割の要旨 | |||||||||||||||||||||||||||||||||
| (1)分割の日程(予定) | |||||||||||||||||||||||||||||||||
| : | 分割契約書承認取締役会 分割契約書調印 分割契約書承認株主総会 分割期日 分割登記 |
平成15年 5月19日 平成15年 5月19日 平成15年 6月27日 平成15年10月 1日 平成15年10月 1日 |
|||||||||||||||||||||||||||||||
| (2)分割方式 | |||||||||||||||||||||||||||||||||
| 当社を分割会社とし、設立予定の準備会社(商号未定)を承継会社とする物的吸収分割(当社が完全親会社となる分社型会社分割)である。 | |||||||||||||||||||||||||||||||||
| (3)分割により承継する事業および権利義務 | |||||||||||||||||||||||||||||||||
| 当社医療機器事業および当該事業に係る権利義務(詳細は未定) | |||||||||||||||||||||||||||||||||
| 2.分割後の新会社(承継会社)の概要(予定) | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| 3.本分割が当社の業績に与える影響 | |||||||||||||||||||||||||||||||||
| 新会社(承継会社)は、当社の100%連結子会社となるため、本分割が当社の当面の連結決算に与える影響は軽微と予測される。 | |||||||||||||||||||||||||||||||||
別紙2:ヘルスケア部門の分社(会社分割)について
| 1.会社分割の要旨 | ||||||||||||||||||||||||||||||||||||
| (1)分割の日程(予定) | ||||||||||||||||||||||||||||||||||||
| : | 分割契約書承認取締役会 分割契約書調印 分割契約書承認株主総会 分割期日 分割登記 |
平成15年 5月19日 平成15年 5月19日 平成15年 6月27日 平成16年 4月 1日 平成16年 4月 1日 |
||||||||||||||||||||||||||||||||||
| (2)分割方式 | ||||||||||||||||||||||||||||||||||||
| 当社を分割会社とし、設立予定の準備会社(商号未定)を承継会社とする物的吸収分割(当社が完全親会社となる分社型会社分割)である。 | ||||||||||||||||||||||||||||||||||||
| (3)分割により承継する事業および権利義務 | ||||||||||||||||||||||||||||||||||||
| 当社ヘルスケア事業(製造を除く)および当該事業に係る権利義務(詳細は未定) | ||||||||||||||||||||||||||||||||||||
| 2.分割後の新会社(承継会社)の概要(予定) | ||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
| 3.本分割が当社の業績に与える影響 | ||||||||||||||||||||||||||||||||||||
| 新会社(承継会社)は、当社の100%連結子会社となるため、本分割が当社の当面の連結決算に与える影響は軽微と予測される。 | ||||||||||||||||||||||||||||||||||||
別紙3:製造部門の分社(会社分割)について
| 1.会社分割の要旨 | |||||||||||||||||||||||||||||||||
| (1)分割の日程(予定) | |||||||||||||||||||||||||||||||||
| : | 分割計画(契約)書承認取締役会 分割計画(契約)書承認株主総会 分割期日 分割登記 |
平成16年5月 平成16年6月 平成17年4月1日 平成17年4月1日 |
|||||||||||||||||||||||||||||||
| (2)分割方式 | |||||||||||||||||||||||||||||||||
| 当社を分割会社とする物的分割(当社が完全親会社となる分社型会社分割)である。 | |||||||||||||||||||||||||||||||||
| (3)分割により承継する事業および権利義務 | |||||||||||||||||||||||||||||||||
| 当社製造部門(製剤研究室、富山工場、埼玉工場※を除く)における事業および当該事業に係る権利義務(詳細は未定) ※埼玉工場(ヘルスケア製品の製造部門)については、別途平成17年4月を期して会社分割を行う予定(詳細は未定)。 |
|||||||||||||||||||||||||||||||||
| 2.分割後の新会社の概要(予定) | |||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
| 3.本分割が当社の業績に与える影響 | |||||||||||||||||||||||||||||||||
| 新会社は、当社の100%連結子会社となるため、本分割が当社の当面の連結決算に与える影響は軽微と予測される。 | |||||||||||||||||||||||||||||||||
http://www.mochida.co.jp/ms/ms_idx.htm
持田製薬の基幹分野といえる医薬品では、これまでに独創的な新薬を数多く開発し、世に送り出してきました。古くは眼科用化学療法剤の創製に始まり、ホルモン、酵素、免疫関係分野など、開発領域を広げながら、近年では日本初の抗ウイルス剤、世界に先駆けてのヒト由来の新しい酵素阻害剤、バイオテクノロジー分野でのインターフェロン開発など、オリジナリティの高い製品をたえず創製しつづけています。
また診断試薬では、日本初の妊娠診断補助試薬、モノクローナル抗体を利用した癌診断試薬などを開発しています。
この部門では、持田製薬の代表的な高脂血症治療薬を中心として、事業への確実な寄与を目標のひとつにかかげています。高脂血症を含めて循環器領域の治療・医療に関心が高まる今後、この医薬事業の健全な発展が大いに期待されているところです。
日本経済新聞 2003/2/6
医薬品 受託生産を拡大 ニプロ ライン増設に130億円
医療器具大手のニプロは医薬品の受託生産事業を拡充する。年内に約130億円を投じて子会社の菱山製薬(大阪市、生地義明会長)が抗生物質などの生産ラインを増設する。昨年成立した改正薬事法で医薬品の委託製造が急増する見通しのため、生産設備を増強する。
アビシア、米社キラル(光学活性体)技術を買収
発表文
英アビシアは、キラル技術に強い米シンソン・キラジェニクスの医薬品ファインケミカル事業を買収した。買収したのは約150の中間体および複合キラル化合物を含むポートフォリオ。ラクトンおよび誘導体事業の買収により、アビシアはキラル技術の対応範囲を大幅に拡大し、日欧米の製薬企業へ提案していく。アビシアは医薬品原体・中間体受託事業の拡大に取り組むなかで、ライセンス導入や提携によりキラル技術ポートフォリオを広げてきており、今回の事業買収もその一環。シンソンは医薬原体・中間体の合成や前臨床開発など創薬に用いる技術の権利は維持する。人員や設備も買収に含まない。
26 February 2003 Avecia
Avecia Acquires Chiral Technologies
from Synthon Chiragenics
Avecia today announced the
acquisition of the pharmaceutical fine chemicals business of
Synthon Chiragenics Corporation, of New Jersey, USA, a recognized
leader in chiral technology. The acquisition of the lactones and
derivatives business, terms of which were not disclosed,
significantly extends Avecia Pharmaceuticals' leadership in
chiral technologies.
Avecia gains access to a new range
of C-3, C-4 and C-5 chiral entities - including the key chiral
building block (S)-3-Hydroxy-gamma-butyrolactone - and an
extensive number of new business opportunities.
Synthon retains rights to the
technology for applications in drug discovery and development,
including synthesis of intermediates and APIs, up to and
including pre-clinical development.
The portfolio acquired by Avecia
includes nearly 150 intermediates and complex chiral compounds.
New business opportunities gained range from pre-clinical to
launched compounds and from chiral building blocks to downstream
synthesis of active pharmaceutical ingredients. Customers include
major, emerging and start-up pharma companies in North America,
Europe and Japan.
The range of chiral building blocks
is based on intellectual property developed at Michigan State
University (MSU) and Avecia intends to continue strategic
development work with MSU.
Dr Peter Jackson, Avecia vice
president - Pharmaceutical Products, commented: "This
acquisition further extends Avecia's leadership in chiral
technologies - adding new capabilities and technologies that
complement our existing chiral toolkit and broadening the range
of added-value options for our customers".
Synthon Chiragenics' CEO Scott
Coleridge said: "Avecia is well placed to bring to market
the full technical and commercial value of this portfolio. For
Synthon, the transaction will release key resources that will
accelerate our primary mission in drug discovery and
development".
For Avecia, Dr Jackson continued:
"This is another key step in our pharma business strategy to
deliver benefits in both time and cost to our customers along the
whole drug development pipeline - from pre-clinical to launch.
"In chirals this demands a
broad portfolio of technologies and combinations that are robust,
scaleable and capable of meeting new challenges in the
development and production of ever more complex drug
structures".
Full technology and commercial
transfers to Avecia were completed in January 2003. No Synthon
Chiragenics personnel or facilities are involved in the
acquisition.
Avecia A World Leader in Fine and
Specialty Chemicals
Avecia is a leading global fine and
specialty chemicals company focused on delivering innovative
technology and service excellence to customers across a range of
high technology industries.
Avecia's on-going success is based
on a long track record of innovation and service excellence. With
over $500 million invested across 17 advanced research, technical
service and manufacturing sites in recent years, Avecia operates
globally at the leading edge of technology in its chosen fields.
The knowledge and skills of our
international workforce of 3500 employees have pioneered many
important products which are in everyday use.
With unique capabilities in organic
chemistry, biological & polymer sciences and process
technology, each of our business sectors offers bespoke products
and services to our global customers, supported by highly focused
technical expertise.
子会社の解散に関するお知らせ
当社は、平成15年7月29日開催の取締役会で、下記の通り連結子会社を解散することを決議しましたので、お知らせいたします。
1 .当該子会社の名称等
① 名称 FERMENTACIONES MEXICANAS, S.A. DE C.V.
②本店所在地 メキシコ合衆国ベラクルス州
③ 代表者 取締役社長 井上 道信
2 .解散の理由
当社メキシコ子会社FERMENTACIONES MEXICANAS, S.A. DE
C.V.は、飼料用アミノ酸事業の競争激化のなか、新技術導入等の収益改善努力を続けてまいりました。
しかしながら、原料価格や市況の変動による影響が大きく、将来に向けての安定的収益の確保や事業競争力向上の目処が立ちにくいと判断し、海外事業構造改革の一環として、解散することを決定いたしました。
引き続き、これまで進めてきた付加価値の高いアミノ酸事業の強化に注力してまいります。
3 .当該子会社の概要
| ① 事業内容 | 飼料用アミノ酸の製造販売 | |
| ② 設立年月日 | 1975 年2 月 | |
| ③資本金 | 30,521 千ペソ | |
| ④ 発行済み株式数 | 30,521,577 株 | |
| ⑤ 総資産 | 893,142 千ペソ(2002 年12 月期) | |
| ⑥ 決算期 | 12 月 | |
| ⑦ 従業員数 | 286 名 | |
| ⑧ 出資比率 | 協和発酵工業株式会社100% |
4 .当該子会社の最近3 年間の業績
| 2000年12月期 | 2001年12月期 | 2002年12月期 | |
売上高 |
515,155 千ペソ |
539,365 千ペソ |
511,478 千ペソ |
営業利益 |
-68,103 千ペソ |
-42,199 千ペソ |
-127,677 千ペソ |
当期利益 |
-50,549 千ペソ |
-20,887 千ペソ |
-199,252 千ペソ |
(参考:2003 年7 月28 日現在 1 ペソ = 約11 円35 銭)
5 .解散の日程
平成16年3月末までに解散を予定しています。
6 .業績への影響
当社は、当該子会社の業績動向に鑑み、過年度の決算(連結および個別)において、当該子会社の株式評価損等を海外事業等構造改革損失として特別損失に計上しております。
今後清算の過程で追加的に発生する費用等の金額が明確になった時点で、平成15年5月14日に公表いたしました当社の平成16年3月期業績予想(連結および個別)の修正の必要が生じた場合には、あらためてお知らせいたします。
生体骨より高強度で、骨伝導性と生体内吸収性を合わせもつ、世界初の骨接合材料「スーパーフィクソーブ30」発売開始。
http://www.takiron.co.jp/new/2003_09_11.htm
タキロン株式会社(大阪市中央区 森下誠二社長)は、生体に活性なバイオセラミックスの微粒子(u-HA)とポリ-L-乳酸(PLLA)を、特殊な方法で複合化し、生体骨より高い強度と、生体内吸収性と生体活性を兼ね備えた、世界初の生体内吸収性骨接合材料「スーパーフィクソーブ30」の医療用品承認を取得、本年11月から発売を開始する。
「スーパーフィクソーブ30」は、これまでのポリ乳酸製品と同様に、生体内で分解吸収されるため、抜去のための再手術が不要で、患者の負担が軽減できる。金属のように腐蝕の危惧がない。などのほか下記の種々の新しい特徴を持っている。
これまでもこの種の複合材の開発を目的に各方面から研究されていたが、強度が生体骨より高く、その強度を骨癒合に必要な最低期間(3~4カ月)維持し、生体内にあって安全であるといった諸条件を満たすものは造られていなかった。
今回発売する「スーパーフィクソーブ30」は、HA粒子とPLLAを複合し、これを独自の特殊な成形法で、より高い強度の複合体をつくることに成功したもので、生体骨より高い強度をもち、その強度の維持は(4~6カ月)に及ぶ。また新しい機能として、生体内吸収性と生体活性(骨伝導能・骨置換)とを兼ね備え、完全吸収して骨と置換する期間短縮を実現した等、第三世代の代表的なバイオマテリアルに位置した世界初の広用途の骨接合材である。
生産は安富工場(兵庫県安富町)に、新工場を竣工ずみで、EN46001(海外向け医療機器の製造に要求される品質マネジメントシステム)の認証も取得しており、近い将来の海外展開に備えている。
売上予測は、スーパーフィクソーブ30で、国内で初年度5億円、3年後に15億円程度の売上を目標としている。
1.承認の概要
承認日:平成15年8月28日
承認番号:21500BZZ00473000 (医療用具の分類:医療用品 4 整形用品)
2.承認された内容
| 1) | 形状、組成 |
| ハイドロキシアパタイト(HA)粒子とポリL乳酸(PLLA)の複合体(composite)からなるスクリュー、ピン、ワッシャ-などの形状の骨接合材です。 その比率はHA/PLLA=30/70(wt%)です。 |
2)使用目的
・骨接合術における骨折の接合
・骨移植術における移植骨の固定
・骨切り術における骨片の固定
・その他:関節の一時的固定(脛腓関節の一時的固定など)に使用されます。
3.スーパーフィクソーブ30について
| (概要) | ||
| : | スーパーフィクソーブ30は、HA粒子とPLLAの複合材料であり、生体内吸収性と生体活性(骨伝導能)とを兼ね備え、第三世代の代表的なバイオマテリアルに位置した、世界初の広用途の骨接合材です。 | |
| (製品の特徴) | ||
| 1) | 力学的特性・・・従来の生体内吸収性の骨接合材よりも総合的に優れた力学的特性をもち、ヒト皮質骨に近い剛性を示す。曲げ強度270メガパスカル(250)、曲げ弾性率7.6ギガパスカル(6.5)、衝撃強度は2倍強。カッコ内はPLLAのみから成るフィクソーブの値。圧縮強度はヒト皮質骨の10倍強を実測した。 | |
| 2) | 分解吸収性・・・分解吸収に要する時間が短縮された。 | |
| 3) | 骨伝導性と骨置換性・・・分解吸収の進行に伴って骨接合材の周囲に新生骨が伝導されるため、骨孔が残ることなく新生骨によって置換される。 | |
| 4) | 生体骨との結合性・・・線維性組織を介することなく、周囲の生体骨と直接結合するので、安定した初期固定力が得られる。 | |
| 5) | 生体適合性、安全性・・・生体内吸収性PLLAの中に生体内吸収性、かつ、生体活性であり、生体内に存在するHAに酷似した、非焼成のHA粒子が含まれているので、生体との親和性と安全性がさらに向上している。 | |
| 6) | X線造影性・・・HAがX線不透過性であるため、術後の変化をX線により観察できる。 | |
| (技術上のポイント) | ||
| 1) | HA粒子について | |
| 本品のハイドロキシアパタイト(HA)には、通常のセラミックスとは異なり、焼成も焼結もしていない、生体内に存在しているHAに酷似した、非焼成ハイドロキシアパタイト(u-HA)が用いられている。 u-HAは以下のような特徴を有している。 |
||
| ・ | 完全吸収性のハイドロキシアパタイトであり、非吸収性の他のHAと異なり、組織への物理的刺激が極めて穏やかである。 | |
| ・ | 骨伝導性、骨結合性などの旺盛な生体活性を有する。 | |
| ・ | 徐々に生体内に吸収されるため、組織反応が穏やかである。 | |
| 2)新製法 | ||
| 本品は、力学的強度を向上させるために、独自の強化法を用いている。(日本、米国など広範な世界中の国々で製法および物質特許を取得した)それにより、バランスが良く、この種の複合材料の中では最も高い力学的強度(曲げ強度、引張強度、トルク強度等)を持ち、骨癒合に必要な充分な期間、強度を維持する。 | ||
| 4.製造拠点 | ||
| 安富工場(兵庫県安富町)に新工場が竣工。製造品目追加許可取得済みであり、EN46001(海外向け医療機器の製造に要求される品質マネジメントシステム)の認証も取得しており、近い将来の海外展開に備えている。 | ||
| 5.販売時期と売上予測 | ||
| 平成15年11月より発売開始、本格発売は平成16年1月より。売上予測は、スーパーフィクソーブ30に限っては、国内で初年度5億円、3年後に15億円程度の売上を目指す。 | ||
| 6.その他 | ||
| 6-1海外展開 | ||
| スーパーフィクソーブ30は日本発のオリジナル技術として、要望されている海外展開も計画しており、早ければ2004年の後半に海外への販売も開始する予定である。 | ||
| 6-2今後の展開 | ||
| スーパーフィクソーブ30と同じ材料からなり、生体活性を重視して、HA粒子を40重量%含んだプレート状の骨接合材(スーパーフィクソーブMX40:口腔外科、形成外科、脳外科、その他の外科分野を対象)の承認申請も行っており、二年以内の承認取得を目指している。これにより国内外ともに市場への拡大が期待できる。 | ||
朝日新聞 2003/9/13 発表
骨再生助ける人工骨、半導体洗浄材料を使い開発
骨の再生を助ける人工骨の技術をベンチャー企業が大阪大医学部などとともに開発した。半導体洗浄用の水を通す目に見えない無数の穴が開いたフィルター製造技術を活用、厚生労働省の承認を得て、健康保険の適用が決まり、24日から市販される。骨に埋め込むと、穴の中に血液や細胞が入り込み、新生骨が形成され、骨の再生を支える。骨がんや重い骨折、骨粗鬆症(こつそしょうしょう)の治療に役立てられそうだ。
医療器具販売を手がける社員約20人のベンチャー企業エム・エム・ティー(大阪市)と半導体材料メーカーの東芝セラミックス、阪大医学部の吉川秀樹教授(整形外科)らが約4年前から共同で研究。独立行政法人の物質・材料研究機構も協力し、臨床試験などを経て、厚労省は今年6月に承認した。
商品名は「ネオボーン」で、価格は556~51万5000円。骨の主成分であるハイドロキシアパタイト(リン酸カルシウム結晶)と呼ばれる物質でできており、角砂糖のような印象だ。
直径約150マイクロメートル(1マイクロメートルは1千分の1ミリ)の穴が無数に開いており、穴と穴同士は約40マイクロメートルの「窓」でつながっている。「連通孔」と呼ばれるもので、特許は東芝セラミックスが持っている。
東芝セラミックスは当初、半導体の製造工程で出る廃水の濾過(ろか)フィルター用の材料として研究していたが、エム・エム・ティーと阪大の協力で、医療技術に発展した。
エム・エム・ティーによると、人工骨の国内市場規模は約60億円。今回の商品投入で「3年以内に倍増する」と見ている。吉川教授は「骨の治療期間が短縮できるだろう。骨再生以外にも再生医療の『足場』として使える可能性があり、用途は今後広がりそうだ」と話す。国内に約1千万人いると言われる骨粗鬆症患者のほか、骨がんや重度の骨折の患者に対し、質の高い治療ができる、と期待されている。
新機能セラミックス人工骨補填材(商品名:NEOBONERネオボーン)の医療用具製造承認取得について http://www.tocera.co.jp/ja/ir/index.html
〔製造承認された骨補填材の特徴〕
全く新しいコンセプトによる、高機能生体活性素材技術
今までに無い微細三次元気孔連結構造の制御により、セラミック素材内深部まで新生骨を伝達
迅速な新生骨の形成を前臨床試験(動物実験)と臨床治験で実証
種々の形状に加工可能で、各種疾患や広範な再生医療への用途展開が可能
〔概要〕
本開発品NEOBONERは、東芝セラミックス(株)と(株)エム・エム・ティーより、厚生労働省に薬事承認申請が行われ、約2年間の審査を経て、平成15年6月17日に医療用具製造承認を取得しました。
NEOBONERは、動物実験に引き続き、臨床治験において各種疾患に適用されました。その結果、素材ブロック内部まで生体組織の迅速な侵入と良好な骨伝導能が確認され、全ての症例で優れた骨形成能と取扱いの容易さが実証されました。
また、NEOBONERは容易に生体組織が侵入し、生体親和性に優れ、適度な強度があるため取扱いが容易である等の特徴を兼ね備えていることから、近年注目を集めている再生医療や組織工学における足場材(scaffold)として様々な分野での適用、応用が期待されます。
NEOBONERは東芝セラミックス(株)の中期経営計画で掲げる非半導体分野におけるバイオ事業の第一弾として具体化したものです。
〔本文〕
東芝セラミックス(株)(本社・東京都新宿区、取締役社長・鈴木紘一)は、大阪大学医学部整形外科吉川秀樹教授、文部科学省無機材質研究所(現(独)物質・材料研究機構生体材料研究センター田中順三センター長)、(株)エム・エム・ティー(大阪市中央区、取締役社長 真崎 修)と協同で、今までにない新しいコンセプトに基づいて、人工骨補填材用の多孔質セラミックス(材質:ハイドロキシアパタイト、商品名:NEOBONERネオボーン)を設計・作製する技術を開発致しました。
人体の骨や歯の主成分であるハイドロキシアパタイトの安全性は既に周知のものであり、多孔質ハイドロキシアパタイト人工骨補填材製品は数社から販売されていますが、いずれの製品も患部埋入後の新生骨形成が材料表層部に限定されることから、強度面での不利、傷病の治癒までの期間が長くなる等の欠点がありました。そのため患者の肉体的・精神的及び経済的な負担が大きいものでした。
NEOBONERは、骨補填材の機能として、生体組織が速やかに内部まで入り込み組織(新生骨)を迅速に形成することが必須であるとのコンセプトにより、生体組織が容易に侵入し、組織形成を助ける多孔体構造とすることで既存材料の問題点を解決しています。この多孔体構造は、生体組織が定着し組織を形成しやすいほぼ球状の150~200μmの気孔と、生体組織(細胞や血液等)が容易に内部まで侵入するために気孔が互いに三次元的に連通する部分の径を10μm以上とすることと、生体組織が侵入し利用可能な気孔体積を大きくすることにより実現されています。さらに、NEOBONERの多孔体側壁は強度の高い緻密な焼結体となっており、手術時・術後の取扱いや機械的負荷に対して十分な強度をあわせ持っています(添付写真-1、2)。
前臨床試験(動物試験)では、生体組織の迅速な侵入と良好な骨伝導能(新生骨の形成能力と強度の発現)を確認し、NEOBONERの多孔体構造が持つ有効性が実証されました。引き続き大阪大学医学部付属病院及び関連3病院にて骨腫瘍、骨折の骨欠損、骨欠損を伴った変形性関節症、慢性関節リウマチの成人患者を対象に65症例の臨床治験が実施されました。各種疾患に適用した臨床治験では、全ての症例で移植後の炎症反応は認められず、レントゲン評価によるとわずか2ヶ月で半数以上の症例で移植した部分が骨硬化し、安全性と優れた骨伝導能が実証されました。
特に骨形成の速さは、従来の多孔質人工骨補填材と比べ速やであるため、固定期間、免荷期間が大幅に短縮でき、従来、強固な金属製内固定が必要とされた症例でも不要になるなど患者の治癒までの肉体的・精神的負荷の大幅な軽減、医療費の削減、入院期間・リハビリテーション期間の短縮による早期社会復帰等の幅広い効果が見込まれます。総合的には現在最も良いとされている自家骨移植にせまる性能であり、新世代の人工骨補填材として有望である期待されます。
さらにNEOBONERは容易に生体組織が侵入し、優れた生体親和性を持ち、かつ適度な強度があるため取扱いが容易である等の足場材として有用な特徴を兼ね備えており、近年注目を集めています再生医療や組織工学における足場材(scaffold)として優れた材料となると考えています。
東芝セラミックス(株)では、H15年5月に発表した中期経営計画において成長市場向けにリソースを集中し、強みを発揮できる半導体関連製品に加えて、環境、エネルギー、バイオ分野である非半導体事業の育成により、収益基盤を強化する方針を打ち出しました。今回、製品化したNEOBONERはバイオ事業分野への第一弾として位置づけております。
なお、 現在神奈川県に申請中の製造業許可取得後、本製品NEOBONERは東芝セラミックス(株)にて製造、(株)エム・エム・ティーより販売を行い、3年後には50~100億円の売上を予想しています。
"シエーリングAGが再生医療に焦点をあてた新たな研究施設を神戸に設置"
http://www.schering.co.jp/release/re20030916.html
2003年9月16日神戸発:日本シエーリング株式会社(本社:大阪市、社長:ホセ・E・マルティーノ アルバ)[ 独シエーリングAG(本社:ドイツ ベルリン市、フランクフルト証券市場:SCH、NY証券市場:SHR)の子会社 ]は再生医療の研究を拡大するために、新たな研究施設である「日本シエーリングリサーチセンター」を神戸医療産業都市構想の中核施設の一つであるバイオメディカルアクセレレーター(BMA:起業化支援施設)に開設することを、発表しました。
新しいリサーチセンターは、世界的なシエーリンググループの研究組織の中で、再生医療領域の研究を推進します。再生医療は遺伝子治療、細胞治療といった革新的な研究を含み、身体・脳の生理機能の再生・回復を目的としています。再生医療は、医療の必要性が高いパーキンソン病や不安定狭心症といった不治の衰弱性慢性疾患の治療に役立つことが、大きく期待されています。
神戸市は「神戸医療産業都市構想」を推進しており、新規事業の創造や国内外の医療関連企業・機関の集結を促進することにより、神戸を最先端の医療技術の研究開発拠点として確立させることを意図しています。その結果、神戸には企業や大学の研究施設とともに理化学研究所の「発生・再生科学総合研究センター」や先端医療センターといった研究機関が集まり、世界レベルのクラスターが形成されます。シエーリングはこのクラスターに進出する初の大手外資系製薬企業となります。
シエーリングは現在、大阪および茂原で行なっている研究を神戸の新たな"日本シエーリングリサーチセンター"に集約させ、新しい施設である
"バイオメディカルアクセレレーター(BMA:起業化支援施設)"に入居します。建設は次年度半ばには完成の予定です。なお、新たなシエーリングリサーチ施設は約40名の研究者の陣容で、2004年に稼動する予定です。
日本での研究活動は神経系や循環器系の再生医療ならびに腫瘍領域に集中します。 「日本シエーリングリサーチセンター」は、米国や欧州にあるシエーリングの研究組織の重要なパートナーで、一体となって活動します。
Prof.ギュンター・ストック(シエーリングAG代表取締役研究開発担当責任者) は、「我々は、再生医療の分野で大きな役割を担うにふさわしい地位を占めており、神戸での新たな研究活動は極めて有望な将来への投資です。 神戸の施設は我々に現代の高度なリサーチクラスターの利点を提供してくれます。 未だ対処法がない医療ニーズに対し、治療の選択を提供することが、探索研究における我々の戦略です。バイパス療法の AGT やパーキンソン病治療のためのSpheramineといった細胞療法という、再生医療領域において我々は二つの期待される開発後期段階の製品を持っています」と、述べています。
「日本シエーリングは、神戸医療産業都市構想が提供する設備を活用することで、シエーリンググループの研究および幅広く医療に対して、より良い貢献ができるものと、期待しています」と、ホセ・E・マルティーノ アルバ日本シエーリング社長は述べています。
Chemical & Engineering News
June 21, 2004
Supreme Court Nixes Foreigners’
Suits In U.S. Courts
http://pubs.acs.org/cen/news/8225/8225notw5.html
In a case involving vitamin price
fixing, the U.S. Supreme Court ruled that non-U.S. claimants cannot
sue international companies in U.S. courts for antitrust
violations occurring abroad.
But the Supreme Court left an
opening for foreign plaintiffs. It sent back to a lower court the
question of whether
price-fixing arrangements in the U.S. led to higher vitamin
prices for foreign buyers. If
so, then foreign buyers now pressing a class-action lawsuit
against BASF, Roche, Aventis, and others may still be able to
continue their case.
Vitamin makers have been on the
defensive since 1999 when U.S. and European authorities convicted
many of participating in an international price-fixing cartel.
For now, however, the court’s
ruling is a victory for the vitamin makers, who are subjects of a
suit brought by buyers in Australia, Ecuador, Panama, and
Ukraine.
The ruling is also a victory for
other multinationals. Many big firms feared international
plaintiffs would sue in U.S. courts to wrest big settlementsーand the treble damages allowed under U.S.
lawーfor transgressions
outside the U.S.
The court’s decision should also make a number of
foreign governments happy. They have complained that suits like
those brought by vitamin buyers operating outside of the U.S.
usurped their authority. The justices agreed that U.S. courts
ought to avoid unreasonable interference with the sovereign
authority of other nations.
2004/7/22 シミック/エスエス製薬
シミック株式会社とエスエス製薬株式会社
子会社株式譲渡で合意
http://www.cmic.co.jp/j/inv/pdf/press_20040722_1.pdf
シミック株式会社(本社:東京、社長:中村和男、以下「シミック」)とエスエス製薬株式会社(本社:東京、社長:萱生統、以下「エスエス製薬」)は、平成16
年7 月28 日をもって、エスエス製薬の100%子会社である株式会社応用医学研究所(本社:北海道、社長:大野洋光)の株式譲渡契約を締結することで基本合意いたしましたので、下記のとおりお知らせいたします。
1.株式譲渡の背景及び目的
株式会社応用医学研究所は、医薬品等の安定性試験を受託しており、技術専門性の高さとコストパフォーマンスの良さを特長としております。シミックは、株式会社応用医学研究所を傘下に収めることにより、臨床試験支援事業においてコンサルティング機能の強化、新規顧客の開拓、財務基盤の強化等に貢献できると考え、全株式の取得を決定いたしました。エスエス製薬は、セルフメディケーションビジネスへの経営資源の選択と集中の方針のもと、子会社戦略の見直しを行った結果、よりふさわしいビジネスパートナーの下において、今後応用医学研究所の事業を発展させることが望ましいものと考え、全株式の譲渡を決定いたしました。
2.方法
株式会社応用医学研究所発行済普通株式122
万株(100%)をシミックがエスエス製薬から取得
3.当該子会社の概要
| (1) 商号 | : | 株式会社応用医学研究所 |
| (2) 代表者 | 大野洋光 | |
| (3) 所在地 | 北海道札幌市中央区南26 条西14 丁目1-10 | |
| (4) 設立年月日 | 昭和55 年12 月24 日 | |
| (5) 事業の内容 | 非臨床試験の受託 | |
| (6) 決算期 | 3月31 日 | |
| (7) 従業員数 | 68 名 | |
| (8) 事務所 | 北海道札幌市中央区南26
条西14 丁目1-10(本社・本社研究所) 北海道札幌市北区新川1条4 丁目1-1(札幌研究所) 北海道石狩市花川南8 条3 丁目81-1(石狩研究所) 東京都千代田区岩本町2 丁目7-13(東京事務所) |
|
| (9) 資本金 | 610 百万円 | |
| (10)出資比率 | エスエス製薬株式会社(所有割合100%) | |
| (11)総資産及び業績 |
平成15年3月期 平成16年3月期 売上高
857百万円
1,003百万円
売上総利益
371百万円
424百万円
営業利益
221百万円
244百万円
経常利益
214百万円
237百万円
総資産
1,014百万円
1,136百万円
4.シミックの取得株式数、取得金額及び取得前後の所有株式の状況
(1)異動前の所有株式数 0
株(所有割合0%)
(2)取得株式数 1,220,000
株(取得価額1,400 百万円)
(3)異動後の所有株式数 1,220,000
株(所有割合100%)
5.日程
平成16 年7 月28 日株式譲渡契約書締結
【シミック株式会社】
設立: 昭和60 年3 月14 日
資本金: 3,065 百万円
所在地: 東京都品川区西五反田7 丁目10 番4 号
代表者名: 代表取締役会長兼社長中村和男
事業内容: CRO 事業(医薬品開発受託)
【エスエス製薬株式会社】
設立: 昭和2 年10 月29 日
資本金: 10,162 百万円
所在地: 東京都中央区日本橋浜町2-12-4
代表者名: 代表取締役社長萱生統
事業内容:
医薬品、医薬部外品、医療用具、化粧品、食品等の製造・販売
日本経済新聞 2004/8/2
欧州製薬、米市場にシフト 高成長、新薬承認の速さ魅カ 後発品と競争リスクも
欧州の製薬大手が世界最大の市場である米国シフトを強めている。欧州市場は財政再建に伴う独仏の医療費抑制の動きなどにより成長が鈍いのに比べ、米国市場での売り上げは好調で1-6月期決算でも各社の業績を大きく左右した。米国依存の収益構造には特許係争などリスクも伴うが、新薬が受け入れられやすい米国での販売を強化し、巨額の研究開発費を補う狙いから、各社は対米進出を加速させている。
スイスのロシュは1-6月期の医療用医薬品部門の地域別売上高で、北米が前年同期比23%増えた。新しい抗腫瘍剤「アバスティン」などが好調で、売上高に占める比率は欧州の34%に対し、北米が37%。傘下のバイオ大手米ジェネンテックの売上高も29%増え、収益に大きく貫献した。
今後は米市場で、需要の大きい腫瘍関連やHIVなどウイルス関連で新製品を投入していく。
スイスのノバルティスも米国で売上高が13%伸びた。バセラ会長兼CEOは「シェアを拡大し、市場平均を上回る伸びを達成できた」と成果を強調。米マサチューセッツ州の研究拠点に約千人を配置、巨大市場の近くでバイオ医薬の研究開発を急ぐという。
欧州アベンティスは医療用医薬品を柱とする「コア事業」で1-6月期の米国売上高が7%増えた。仏独などのマイナス成長とは対照的だ。仏サノフィ・サンテラボがアベンティス買収を決めたのも、同社が米市場に築いた販売網の獲得が理由の一つだ。
欧州各社が米医薬品市場を重視するのは、世界市場の半分強を占め、10%前後の成長を続けているため。米国では新薬承認の際にスピード審査の制度があり、数年の歳月を要する独仏などとは対照的だ。
欧州市場に比べ、米国では承認・発売から、特許切れまでの収益を上げられる期間がその分長くなる。価格面でも政府が深く関与する欧州に対して、米国では研究開発費や効き目に見合った価格付けがしやすい。
一方で、特許が切れるとすぐに後発品が出て、売上高が激減するリスクも大きい。医療費抑制を目指して、後発品の使用を奨励する米政府の政策が背景にはある。
その代表例が英グラクソスミスクライン(GSK)のケース。同社は主力の抗うつ剤「パキシル」「ウェルブトリン」の米国特許が切れた途端、安価な後発品にシェアを奪われた。米国売上高比率が約5割と高いだけに影響も大きく、1-6月期の全社売上高は6%減と苦杯をなめた。
アベンティスは主力の抗血栓剤の後発品を避けるため既存特許の改定を申請したが、米当局に却下され、後発品の承認差し止め裁判を続けている。サノフィも後発品メーカーと係争中だ。
米医薬品市場の成長率が徐々に鈍るとの見方もある中、欧州医薬品各社は開発ぺ-スを従来以上に短縮。新たな製品を次々と投入せざるを得なくなりつつある。
欧州製薬大手の2004年1-6月期医療用医薬品の米国売上高の比率と伸ぴ率
| 企業 | 米国比率 (%) |
米国の 前年比 伸び率(%) |
グラクソスミスクライン |
50 |
0 |
アストラゼネカ |
44 |
3 |
アベンティス |
36 |
7 |
ノバルティス |
40 |
13 |
ロシュ |
37 |
23 |
サノフイ・サンテラボ |
24 |
36 |
(注)米国の前年比伸び率は為替変動の影響含まず。
アベンティスはワクチン事業などを含むコア事業
ノーベル医学生理学賞:ピロリ菌発見の豪州2博士に
スウェーデンのカロリンスカ研究所は3日、05年のノーベル医学生理学賞を豪州の西オーストラリア大のバリー・マーシャル教授(54)とロビン・ウォーレン名誉教授(68)に授与すると発表した。両氏は82年、細菌の一種のヘリコバクター・ピロリ(Helicobacter
pylori ピロリ菌)を発見し、ピロリ菌の感染が胃潰瘍(かいよう)や十二指腸潰瘍の原因になることを突き止めた。
授賞式は12月10日、ストックホルムで開かれる。賞金の1000万クローナ(約1億5000万円)は両氏に半分ずつ贈られる。
消化器の潰瘍は、ストレスや生活習慣が原因だと考えられていた。病理医だったウォーレン氏は70年代末、胃の一部の組織を切り取る検査を受けた患者の半数で、胃の下部にらせん状の細菌が集まり、その周辺で胃粘膜が炎症を起こしていることを発見した。
マーシャル氏は82年、この細菌の分離と培養に成功し、ヘリコバクター・ピロリと名づけた。胃や十二指腸に潰瘍を持つ患者のほとんどが持っていることから、ピロリ菌が潰瘍の原因だと提唱した。ピロリ菌の除去で潰瘍が治ることも示した。
胃潰瘍と同様に慢性的な炎症が起きる、潰瘍性大腸炎やクローン病などの研究にも新しい視点を提供することになった。
強い酸性の胃液が出る胃の中に細菌がすめるはずはないとされ、ピロリ菌の存在を否定する専門家も多かった。このため、マーシャル氏は自らピロリ菌を飲み、急性胃炎になることと抗生物質で菌を殺すと胃炎が治ることを示し、自説を証明した。
積水化学のメディカル事業と第一化学薬品株式会社を統合
積水化学工業株式会社(代表取締役社長:大久保尚武、以下積水化学)は、高機能プラスチックスカンパニー(プレジデント:松永隆善)のメディカル事業部で展開する事業と、昨年10月に買収した100%子会社である第一化学薬品株式会社(代表取締役社長:蘆田伸一郎、以下第一化学薬品)を、第一化学薬品の組織を母体として来年4月に統合します。これを機に、「組織の一体化による事業運営の効率化」と「事業の選択と集中」を進め、積水化学グループの戦略事業分野であるメディカル事業のさらなる拡大・発展を目指します。
さらに、事業統合に合わせて第一化学薬品の社名を変更し、「積水化学グループのメディカル事業会社」として、医療業界におけるプレゼンスの向上を図ります。
1.積水化学グループ内のメディカル事業統合および第一化学薬品の社名変更のねらい
| 今回の施策のねらいは以下の3点です。 | |
| 1) | 組織の一体化による事業運営効率の向上 積水化学のメディカル事業を第一化学薬品に移管・統合し、第一化学薬品を母体として事業運営効率の向上を図ります。 |
| 2) | 事業の選択と集中による拡大・発展 事業統合後の新会社は、検査領域を柱とした事業の選択と、開発・生産・販売において経営資源の集中を図り、さらなる事業の拡大・発展を目指します。 |
| 3) | 医療業界におけるプレゼンスの向上 2008年4月に第一化学薬品の社名を変更し、「積水化学グループのメディカル事業会社」として医療業界におけるプレゼンスの向上を図ります。 |
2.事業統合に向けた第一化学薬品の社長交代について
6月26日付で、蘆田伸一郎(あしだ
しんいちろう)現社長に代わり、積水化学の取締役メディカル事業部長の福田睦(ふくだ
むつみ)が第一化学薬品の社長に就任(予定)し、来年4月の事業統合に向けた準備を加速させます。
3.新会社概要(予定)
1)社名 「積水」を冠する社名に変更
2)事業内容
検査薬、医療用具、医薬品の製造・販売、創薬支援事業など
3)実施日 2008年4月1日
4)代表取締役社長 福田 睦(現 積水化学
取締役
高機能プラスチックスカンパニーメディカル事業部長)
5)売上高
350億円(2006年度実績ベース)
6)従業員数 800名
7)資本金 1,275百万円
8)出資形態 積水化学工業株式会社 100%
9)本社所在地 東京都中央区日本橋3-13-5(現第一化学薬品本社所在地に同じ)
<ご参考:積水化学のメディカル事業および第一化学薬品の概要>
■積水化学のメディカル事業
事業開始 昭和58(1983)年
事業内容
検査薬、医療用具、テープ医薬品などの製造・販売
事業拠点 営業所:東京、大阪
工 場:兵庫、山口
研究所:大阪
海外事業会社(中国・北京)
海外販売会社(ドイツ、米国など7社)
■第一化学薬品
設立年月日
昭和22(1947)年7月10日
事業内容
検査薬、研究用試薬、化学薬品の製造・販売、薬物動態研究
事業拠点
営業所:東京、名古屋、大阪など10箇所
工 場:茨城、岩手
研究所:茨城
海外販売会社(中国・上海)