2004 年9月15 日 山之内製薬/藤沢薬品
アステラス製薬株式会社の経営理念、ブランドマーク、コーポレートメッセージの制定について http://www.yamanouchi.com/jp/news/news2004/040915.pdf
山之内製薬株式会社(本社:東京、社長:竹中登一、以下「山之内製薬」)と藤沢薬品工業株式会社(本社:大阪、社長:青木初夫、以下「藤沢薬品」)は、関係当局の承認を前提に2005年4月1日に合併し、「 アステラス製薬株式会社 」(以下、「アステラス製薬」)としてスタートいたします。この度、アステラス製薬の「経営理念」、「ブランドマーク」、「コーポレートメッセージ」を制定いたしましたのでお知らせいたします。
【存在意義】
:
先端・信頼の医薬で、世界の人々の健康に貢献する生命科学の未知なる可能性を、誰よりも深く究めたい。
新しい挑戦を続け、最先端の医薬品を生み出したい。
【使命】
企業価値の持続的向上
アステラスは、企業価値向上のため、お客様、株主、社員、環境・社会など、すべてのステークホルダーから選ばれ、信頼されることを目指します。
【信条】
アステラスの「信条」は、私たちが常に大事にする行動規範です。
2.ブランドマーク、コーポレートメッセージ
【ブランドマーク】
アステラス製薬のシンボルには、未来に向かって進む美しく輝く星を表すデザインを採用し、“フライング・スター”と名付けました。信頼に裏付けられた最先端のサイエンス&テクノロジーと斬新なインサイトで、健康を願う人すべてに、希望と高揚感をもたらし、新時代を照らしてゆく新生「アステラス」の企業姿勢を表現したデザインです。
【コーポレートメッセージ】
Leading Light for Life www.astellas.com/jp/ )
日本経済新聞 2004/11/10
発表
アステラス製薬の統合スケジュール
日本 海外
▽2005年
アステラス製薬発足(4月)
・
新営業体制発足(181営業所、MR数2700人)
・
研究所・開発部門統合
・
山之内工場分社
・
物流機能外注化
賃金制度統合
(10月)
北米事業会社統合(4月)
藤沢の台湾工場閉鎖
(6月)
欧州各国販社の統合開始(10月)
▽2006年
藤沢の大阪工場閉鎖(3月) 中国販社統合(4月以降)
2005 年3 月17 日 山之内製薬/藤沢薬品工業
アステラス製薬株式会社海外グループ会社の編成について http://www.yamanouchi.com/jp/news/news2005/050317.pdf
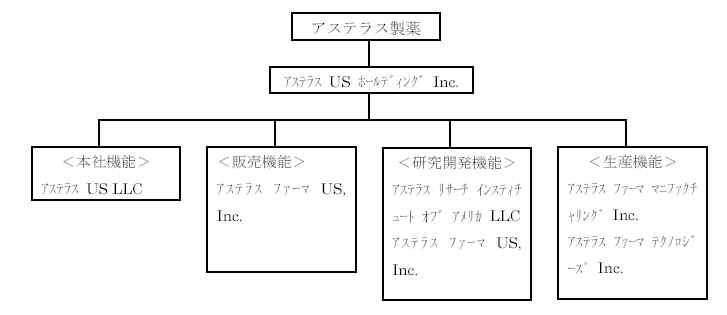
<北米の主要拠点の再編概要>
新会社名 再編対象会社 主な機能 所在地
アステラスUS
ホールディングInc. 山之内US
ホールディングInc. 持株会社 米国
アステラスUS LLC 新設(フジサワヘルスケアInc.と山之内ファーマア 本社機能 米国
アステラスファーマUS,
Inc. フジサワヘルスケアInc. 開発 米国
アステラスファーママニファクチャリングInc. 新設(フジサワヘルスケアInc.のグランドアイランド 生産 米国
アステラスファーマテクノロジーズInc. 山之内ファーマテクノロジーズInc. 生産 米国
アステラスリサーチインスティチュートオブアメリカLLC フジサワリサーチインスティチュートオブアメリカInc. 研究 米国
アステラスベンチャーキャピタルLLC 山之内ベンチャーキャピタルLLC 投資会社 米国
アステラスファーマカナダInc. フジサワカナダInc. 開発 カナダ
<再編後の北米の資本・機能構成(主たるグループ会社のみ記載)>
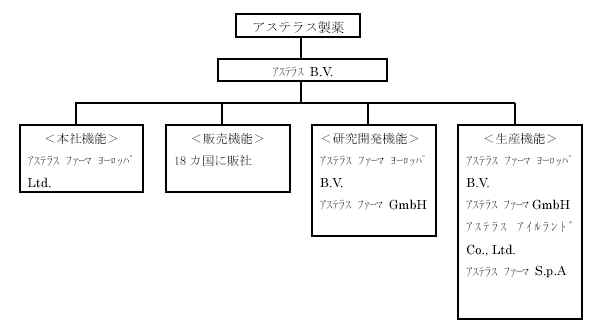
<欧州の主要拠点の再編概要>
新会社名 再編対象会社 主な機能 所在国
アステラスB.V. 山之内B.V. 持株会社 オランダ
アステラスファーマヨーロッパLtd. 山之内U.K. Limited 本社機能 英国
アステラスファーマヨーロッパB.V. 山之内ヨーロッパB.V. 研究開発 オランダ
アステラスファーマGmbH フジサワGmbH 開発 ドイツ
アステラスアイルランドCo.,
Ltd. フジサワアイルランドLtd. 生産 アイルランド
アステラスファーマS.p.A. 山之内ファーマS.p.A. 生産 イタリア
<再編後の欧州の資本・機能構成(主たるグループ会社のみ記載)>
<アジアの主要拠点の再編概要>
新会社名 再編対象会社 主な機能
韓国アステラス製薬株式会社 韓国藤沢薬品株式会社 販売
台湾アステラス製薬股イ分有限公司 台湾藤沢薬品工業股イ分有限公司 販売
アステラス製薬(中国)有限公司 山之内製薬(中国)有限公司 生産
香港アステラス製薬有限公司 藤沢薬品(中国)有限公司 販売
アステラスファーマフィリピンInc. 山之内フィリピン 販売
アステラスファーマタイランドCo.,
Ltd. 山之内タイランド 販売
P.T.
アステラスファーマインドネシア 山之内インドネシア 販売
2005年4月1日 アステラス製薬 http://www.astellas.com/jp/company/news/2005/pdf/050401.pdf
山之内製薬株式会社(以下「山之内製薬」)と藤沢薬品工業株式会社(以下「藤沢薬品」)は本日合併し、「アステラス製薬株式会社」(本社:東京、社長:竹中登一、以下「アステラス製薬」)が発足しましたのでお知らせいたします。
(1)商号 アステラス製薬株式会社
(2)主要な事業 医療用医薬品の製造・販売および輸出入
(3)本店所在地 東京都中央区日本橋本町2
丁目3 番11 号
(4)代表者 代表取締役会長 青木初夫
(5)役員数 取締役 8
名(うち 2名が社外取締役)
(6)事業拠点 日本、北米(米国、カナダ)、欧州(18
カ国に販売拠点)、アジア(韓国、
(7)要員数 連結要員数約17,000
2005/05/16 アステラス製薬
アステラス製薬の医療関連製品事業からの撤退について http://www.astellas.com/jp/company/news/2005/pdf/050516_a.pdf
アステラス製薬株式会社(本社:東京、社長:竹中登一 以下「アステラス製薬」)は、このたび、医療関連製品事業から撤退することを決定しましたのでお知らせします。
1.研究用試薬
・ 各種モノクローナル抗体をはじめとするBecton,
Dickinson and Company
の製品につきましては、本年9月末日をもって日本べクトン・ディッキンソン社に販売を移管します。この移管に伴い、当社の医療関連事業部より従業員の一部が同社に移籍する予定です。
・ 遺伝子解析用試薬であるVysis,
Inc.の製品につきましては、臨床検査用試薬を含め、本年9月末日をもって同社の親会社であるAbbott
Laboratoriesの日本法人であるアボットジャパン株式会社に販売を移管します。
2.臨床検査用試薬
・ 尿検査試薬を始めとする臨床検査用試薬の今後につきましては、現時点では未定です。
なお、臓器移植に使われる臓器保存液「ビアスパン」は当社での扱いを継続します。また、本件が当社の業績に与える影響は軽微です。
2005年10月4日 アステラス製薬
マーライオン社との共同研究契約締結のお知らせ http://www.astellas.com/jp/company/news/2005/pdf/051004_a.pdf
アステラス製薬株式会社(本社:東京、社長:竹中
登一、以下「アステラス製薬」)は、このほど、シンガポールの医薬品リサーチベンチャー「マーライオン
ファーマシューティカルズ社」(マーライオン社)と、天然物由来の醗酵探索に関する共同研究契約を締結しましたので、お知らせします。 www.merlionpharma.com
朝日新聞 2006/2/9 両社否定 第一三共 大衆薬ゼファーマを買収
アステラス製薬 2006/2/9
本日の新聞報道についての当社コメント
2006/4/17 アステラス製薬
2006/12/21 アステラス製薬 アステラス ドイチェランド
GmbH(本社:ドイツ)のミュンヘン工場、クリンゲアイルランド工場の資産 及び プロディツェオーニ ファーマシューティッツェ カルガーテS.r.l(本社:イタリア、カルガーテ工場)の全株式 を ドイツ医薬品会社テムラーグループ(オーナー:Hans
Joachim Ricken)に一括譲渡 することについて、両社間で合意に達し、12月20日(現地時間)に譲渡契約を締結しましたので、お知らせします。
2009/1/27 アステラス製薬
CV Therapeutics 社に対する1株当たり16ドルの現金を対価とした買収提案
アステラス製薬株式会社は、本日、米国
CV Therapeutics
社の取締役会に対して、同社が発行済みの全ての普通株式を1株あたり16ドルの現金を対価として取得する提案を行いましたので、お知らせします。本提案は2009年1月26日のCV
Therapeutics 社株式の終値に対して41%、直近60日間の終値の平均値に対して69%のプレミアムを加えて価格となり、発行済み株式に対する総額は10億ドルとなります。
アステラス製薬は、CV therapeutics
社の取締役会に対して2008年11月14日付で本提案を行いましたが、11月21日付で、CV
Therapeutics
社の取締役会より提案を拒否する旨の通知を受領しました。また、その後CV
Therapeutics 社は、本件に関して当社との実質的な協議を拒んでいます。
対象会社の概要
会社名 CV Therapeutics, Inc.
今回ヘアステラス製薬が米バイオベンチャー企業への買収提案に動いた背景には、10年前後に主力薬の特許切れが相次ぐという製薬業界共通の経営課題がある。アステラスの場合、08年3月期に年間売上高2030億円に達した主力の免疫抑制剤「プログラフ」の特許が、主戦場の米国で08年4月に切れた。プログラフだけで連結売上高の20%を占めるが今後、欧州でも09年6月、日本でも10年12月と、次々に特許切れを迎える。
最近の世界の製薬会社による主な買収案件
会社名 買収対象企業 買収金額(億円)
アステラス製薬 米アジェンシス 430
エーザイ 米MGIファーマ 4,100
武田薬品工業 米アムジェン日本法人 900
武田薬品工業 米ミレニアム・ファーマシューティカルズ
9,300
第一三共 独ユースリー・ファーマ 250
塩野義製薬 米サイエル・ファーマ 1,500
第一三共 印ランバクシー・ラボラトリーズ
4,900
米フアイザー 米ワイス 61,000
アステラス製薬 米CVセラピューティクス 890(買収提案額)
Mar. 12, 2009--
Gilead Sciences アステラス製薬による敵対的買収
Gilead Sciences Agrees to
Acquire CV Therapeutics for $20.00 Per Share ’
Board of Directors
has unanimously approved the transaction and has agreed to
recommend to its stockholders that they tender their shares
pursuant to the tender offer. CV Therapeutics will become a
wholly-owned subsidiary of Gilead. The transaction is valued at
approximately $1.4 billion and is expected to be dilutive to
Gilead ’ s earnings in 2009, neutral to
accretive in 2010 and accretive in 2011 and beyond.
2009年7月 1日
蛋白医薬品開発を目的とするマキシジェン社との合弁会社設立に関するお知らせ
アステラス製薬株式会社(本社:東京都、社長:野木森
雅郁、以下「アステラス製薬」)は、このたび、米国の医薬品会社マキシジェン社(英名: Maxygen, Inc .、本社:カリフォルニア州レッドウッドシティ、CEO:Russell
Howard)と、 MAXY-4 およびそれ以外の初期段階にある創薬研究プログラムを含む多様な蛋白医薬品の研究開発を行なう合弁会社設立に関する契約
(以下、「本契約」)を締結しましたので、お知らせします。
2008/9/19
タンパク医薬の典型的なものが、抗体医薬といわれるものです。最近はやりのバイオ技術です。医薬というと通常
合成された化学物質で純度が高く効き目は抜群ですが、副作用がでることが多い。これに対し、バイオ合成は生体(動物も含めて)合成したもので、生体に近い
為に副作用が非常に少ないものです。最近、盛んに研究されています。
本契約に基づき、マキシジェン社は、既に両社で提携関係にあるMAXY-4の研究開発プログラムを含む蛋白医薬品に関する同社の実質的にすべてのプログラ
ムならびに当該プログラムの研究開発に必要な技術等の資産とともに、現金10百万ドルを新たに設立される合弁会社に出資します。これを対価として、同社は
合弁会社の約83%の持分を取得します。アステラス製薬は10百万ドルを出資し、その対価として合弁会社の約17%の持分を取得します。また、アステラス
製薬は、合弁会社設立から3年目まで、53百万ドルから123百万ドルの間で各四半期毎に増加していく事前設定価格で、マキシジェン社が保有する合弁会社
の全持分を取得する持分買取選択権を有します。同合弁会社のCEOには、マキシジェン社のChief
Business Officerを務めるGrant Yonehiro氏が就任する予定です。
2009年3月16日
米国医薬品会社CV Therapeutics社に対する買収提案終結に関するお知らせ
アステラス製薬株式会社(本社:東京、社長:野木森
雅郁)は、本日、米国の医薬品会社であるCV
Therapeutics, Inc.(本社:カリフォルニア州パロアルト、以下「CV
Therapeutics社」)に対する1株あたり16ドルでの株式公開買付けを終了するとともに、CV
Therapeutics社取締役候補の推薦に係わる提案を含め、同社の2009年定時株主総会においていかなる株主提案も行わないことを決定しましたの
で、お知らせします。
当社は2009年1月27日にCV Therapeutics社の取締役会に対して、同社が発行済みの全ての普通株式を1株あたり16ドルの現金を対価として取得する提案を行いました(発行済み株式に対する総額11億ドル)。当
社は、CV Therapeutics社との話し合いを通じた合意を目指していましたが、CV
Therapeutics社取締役会が当社の買収提案を拒否し続けていることから、2月27日より、同社に対して1株あたり16ドルの現金を対価とする株
式公開買付けを開始しました。
また、3月9日付けプレスリリースの通り、CV
Therapeutics社取締役会の選任に係わる株主提案を行うことを公表しました。
これに対して、CV Therapeutics社は、3月12日に Gilead Sciences, Inc.が1株あたり20ドルの現金を対価として同社を買収 することに合意した旨を公表しました。
当社は、CV Therapeutics社より公表されたGilead
Sciences, Inc.による買収価格の水準は当社の株主価値の向上に見合わないものと判断し、このたびCV
Therapeutics社買収提案の終結を決定したものです。
2010/3/1
米国医薬品会社OSI Pharmaceuticals社に対する株式公開買付けの開始に関するお知らせ
アステラス製薬株式会社(本社:東京、社長:野木森雅郁)は、本日、取締役会において、米国の医薬品会社である OSI Pharmaceuticals, Inc. (本社:米国ニューヨーク州メルビル、以下「OSI
Pharmaceuticals 社」)に対して、当社の米国持株子会社アステラスUSホールディングInc.(本社:イリノイ州ディアフィールド)の100%子会社Ruby
Acquisition, Inc.(以下「公開買付者」)が現金による株式公開買付け(以下「本公開買付け」)を行うことを決議いたしましたので、お知らせします。 がん領域を重点疾患領域 に位置づけ、早期の事業基盤確立に向けた取り組みを積極的に進めています。そのために、自社の研究開発力の一層の強化とともに、アライアンス活動を通じてパイプラインの充実を図っています。本公開買付けは、このような当社の取り組みの一環として重要な投資であると考えています。 がん及び糖尿病/肥満の領域において分子標的薬の創製、開発、商業化にフォーカス している医薬品企業です。OSI
Pharmaceuticals
社は、同社が創製した世界でも有数のがん治療剤TarcevaRの製造・販売を通じてがん領域における米国事業基盤を既に構築しているとともに、同領域において複数の新薬候補化合物を開発パイプラインに有しています。 1株あたり52ドルの現金 を対価として取得するものです。これは、OSI
Pharmaceuticals 社株式の2010年2月26日の終値(37.02ドル/株)に対して40%、同日までの直近3ヶ月の終値の平均値(34.01ドル/株)に対して53%、また直近1年間の最高値(39.66ドル/株)に対して31%のプレミアムを加えた価格となり、発行済株式に対する総額は 約35億ドル となります。OSI
Pharmaceuticals
社の株主にとって当社の提案は、現時点でOSI
Pharmaceuticals 社が創出する価値ならびに将来の見込みの双方を評価したものであると考えています。
・ 当社は、当社によるOSI
Pharmaceuticals
社の買収が両社にとって大きな利益を生み出すことができると考えています。すなわち、統合後の会社は、がん領域においてアンメットニーズを抱える患者のために新薬を創製し、開発し、提供していくという両社の目標に対して、それぞれが単独で実現しうるよりもはるかに高い成果を達成できると確信しています。
・ 当社はこれまで両社の事業を統合する可能性について13か月間にわたり貴社と有意義な協議をするために最大限の努力を払ってきました。そして、当社は2010年2月12日に貴社と会談した際に改めて、貴社の全株式を前日の終値に対して約50%のプレミアムを加えた1株あたり52ドルで取得する提案をいたしました。
・ 当社は、2月12日の貴社との会談が、貴社の取締役会において当社からの買収提案ならびに貴社の株主に対する価値還元に関する前向きな協議の契機となることを期待していました。しかしながら、2月22日付け貴社からの書面による回答では、 当社の提案がOSI
Pharmaceuticals
社の価値を極めて低く評価している との主張とともに、2年間のstandstill条項を含む秘密保持契約が提案されました。それは当社が貴社の株主に対して直接提案することを制限するものであり、当社は貴社株主の最善の利益にはならないものと考えています。
・ 2月12日の会談ならびにこれまでの話し合いの中で述べている通り、当社は当社によるOSI
Pharmaceuticals 社の買収が魅力的な提案であり、両社の株主、従業員、顧客に稀有な機会を提供するものと確信しています。しかしながら、貴社が当社との実質的な協議を行う意思がないことから、当社は貴社の株主に直接働きかけるため当社の取締役会の承認にもとづき貴社株式の公開買付けを行うこととしました。
・ 当社は、OSI
Pharmaceuticals
社の既存製品の価値を実現し、貴社パイプラインにある製品の開発及び商業ベースでの成功を確実なものとするために、貴社買収の可能性を引続き追求していきたいと考えています。当社はまた、OSI
Pharmaceuticals 社の組織体制を最大限に尊重したうえ、過去の同様の戦略的な買収においても実施してきたように、OSI
Pharmaceuticals 社の強みを有する事業と従業員を当社の事業に統合するつもりです。
・ 当社は、協議による両社の統合の可能性を引続き追求していく考えです。貴社が当社の提案を再考し、両社にとって有益な結論を導くために共に取り組んでくださることを望んでいます。
アステラス製薬は2009年1月、 CV Therapeutics, Inc に対し、 1株当たり16ドル 、総額 11億ドルでの敵対的買収を提案したが、ギリアド( Gilead Sciences, Inc. )
が3月12日、 1 株当たり 20 ドル、総額 14 億ドルで同社を買収する契約を締結したと発表した。 アステラス側は対応を検討中としているが、諦めるのではないかとの観測がある。
付記
アステラス製薬は3月16日、CVTX買収提案の終結を発表した。 「 CV
Therapeutics社より公表されたGilead Sciences,
Inc.による買収価格の水準は当社の株主価値の向上に見合わないものと判断し、このたびCV
Therapeutics社買収提案の終結を決定したものです 」としている。
2009/3/14 CV
Therapeutics 社に対する買収競争へ
2010年12月8日 Cytori Therapeutics, Inc. (本社:カリフォルニア州サンディエゴ、CEO:Christopher
J. Calhoun、以下「サイトリ社」)との間で体性幹細胞の難病治療への応用可能性を評価するために、戦略的株式投資契約を締結しましたので、お知らせします。
オリンパス、米「サイトリ・セラピューティクス社」に追加投資、連携を強化
2011年05月17日
アステラス製薬、米国パーシード社を100%子会社化
アステラス製薬は17日、米国の医薬品会社Maxygen
から同社が保有するPerseid(本社:カリフォルニア州)株の全持分の買取を完了したと発表した。
2013年4月 5日 アステラス製薬
米国アンブレックス社とのがん領域における次世代ADC技術に関する提携のお知らせ抗体-薬物複合体(ADC) の創製と開発に関する提携契約を締結しましたので、お知らせします。
2012/07/09
2015 年11 月10 日 アステラス製薬 説明資料
米国Ocata 社買収に関する契約締結 および株式公開買付けの開始予定に関するお知らせ
アステラス製薬は、米国のバイオテクノロジー企業 Ocata Therapeutics,
Inc. との間で、当社がOcata 社を買収することで合意し、本日、契約を締結しました。全ての普通株式 を一株当り8.50
米ドルの現金を対価として取得するものです。これは、Ocata 社株式の2015 年11 月6 日終値(4.75
米ドル/株)に対して79%のプレミアムを加えた価格となり、総額は約379 百万米ドル となります。本公開買付け及びその後の合併による買収は、全て現金を対価として行われ、財務上の条件は付されていません。なお、Ocata
社の取締役会は、本公開買付けへの応募をOcata 社株主に推奨する旨の決議をしています。
同社の最も開発が進んでいる萎縮型加齢黄斑変性及びStargardt
病を対象とした網膜色素上皮(RPE: retinal pigment epithelium)細胞プログラムは、現在、臨床試験段階にあります。
hES細胞株から分化誘導したRPE細胞を網膜下に注入移植する治療法。分裂増殖が停止し最終分化した細胞を用いる。
その他にも、眼科疾患を中心に複数の細胞医療プログラムが研究・前臨床段階にあります。
2015年11月11日
(3) 譲渡対価 6億7,500万ユーロ
* プロトピック®については、日本における販売権を2014年4月1日からマルホ株式会社に移管
2010年12月 6日
アトピー性皮膚炎治療剤「プロトピック® 軟膏」のプロモーションおよび販売提携について
マルホとアステラス製薬はこのほど、現在アステラス製薬が製造販売する医療用医薬品のアトピー性皮膚炎治療剤「プロトピック® 軟膏」(一般名:タクロリムス水和物)について、アステラス製薬からマルホへ、日本におけるプロモーション活動を2011年4月1日から委託、また日本における販売権を2014年4月1日から移管 することに合意しましたのでお知らせします。なお、製造販売承認は継続してアステラス製薬が保持します。
両社は、プロトピック軟膏の適正使用を推進し、より多くのアトピー性皮膚炎の患者さんのQOL向上の実現を目指します。
* 「プロトピック® 軟膏」とは、「プロトピック® 軟膏0.1%」および「プロトピック® 軟膏0.03%小児用」を示します。
2016年10月19日
化血研との事業承継に関する協議の終了について
アステラス製薬は、このたび、一般財団法人
化学及血清療法研究所(以下、「化血研」)との間で進めていました同所の事業承継に向けた協議を終了することとしましたので、お知らせします。
当社はこれまで、化血研の事業承継に関して同所と協議を進めてきましたが、交渉の状況などを総合的に判断し協議を終了することを決定しました。
なお、このたびの協議終了の決定による当社が取り扱う化血研製品に関する契約及び取引への影響はありません。
当社は、引き続き化血研製品の販売会社として、適切な情報提供とともに製品の安定供給に最善を尽くしてまいります。
血液製剤を不正に製造していた製薬会社・化血研の事業の譲渡先として交渉がすすめられてきたアステラス製薬が、交渉を打ち切る方針を固めたことがJNNの取材でわかりました。
化血研は、およそ40年前から国の承認とは異なる方法で血液製剤を製造したほか、事実を隠蔽したとして、厚労省が今年1月、過去最長の110日間の業務停止命令を出しています。塩崎厚労大臣が化血研に対し、組織の抜本的な見直し を求めたことから、製薬大手のアステラス製薬に事業を譲渡する方向で交渉が進んでいました。しかし、関係者によりますと、化血研側が「事業の譲渡は難しい」などと難色を示し、交渉は難航、アステラス製薬は交渉を打ち切る方針を固めたということです。
「ワクチン産業の業界再編の推進など、抜本的見直しに向けた提言をいただいた」(塩崎恭久 厚労相)
塩崎大臣は18日、「国内のワクチンメーカーは、組織形態の見直しでガバナンスを強化する必要がある」などとする「業界再編」を求める有識者からの提言を受け、化血研に対し、速やかに事業を譲渡するよう改めて求めました。
化血研の事業をめぐっては国内外の複数の企業が関心を示していて、今後、改めて事業譲渡に向けた交渉が本格化することになります。
---
化血研の2015年3月期決算は売上高が約475億円、営業利益が約127億円。ワクチンや血液製剤、動物向けワクチンなどを手掛けるが、不正発覚で厚労省から事業の抜本的な見直しを求められ、400億~500億円で主力事業をアステラスに譲渡する交渉を進めていた。
2016年10月28日 アステラス製薬
独Ganymed社買収に関する契約締結
-後期開発段階の抗体プログラム獲得によりがん領域パイプラインを拡充-
アステラス製薬は、がんに対する抗体医薬を開発するドイツ
マインツに拠点を置くバイオ医薬品企業Ganymed Pharmaceuticals AG の株主との間で、アステラス製薬がGanymed社を買収することに合意し、契約を締結しましたのでお知らせします。本買収により、アステラス製薬の成長を牽引する中核であるがん領域フランチャイズを、より一層盤石なものとしていきます。
本買収契約に基づき、アステラス製薬は同社の全株式を取得するための契約一時金として4億2,200万ユーロ を支払います。更に、Ganymed社の株主に対し、同社の最も開発が進んでいる臨床開発プログラムIMAB362の開発の進捗に応じて、最大で総額8億6,000万ユーロ を支払う可能性があります。今後アステラス製薬は、必要な法的諸手続きを経て、数週間以内に買収を完了し、Ganymed社を完全子会社化する予定です。
アステラス製薬の代表取締役社長CEOの畑中
好彦は次のように述べています。「がん領域は、アステラスの成長を牽引する重要なフランチャイズの一つです。本買収を通じ、Ganymed社が有する後期開発段階の抗体プログラムを取り込むことにより、がん領域におけるプレゼンスを更に拡大できると考えており、XTANDI® に続くがん領域の新たな中核になるものと期待しています。今後も、アンメットメディカルニーズが高く、既存の治療法では満足のいく効果を得られていないがん患者さんに、新たな治療選択肢を届けてまいります。」
Ganymed社のCEOであり共同創立者であるDr. Özlem
Türeciは、「アステラス製薬の新薬を創出し患者さんに届ける能力、コミットメント、ビジョンに感銘を受けました。アステラス製薬のグローバルな経営資源や研究開発力から、近い将来に科学の進歩と有望な臨床開発の成果を患者さんの価値に変えられるものと確信しています。」と述べています。また、Ganymed社のSupervisory
Boardのメンバーであり、Strüngmann brothers(Athos Beteiligungsverwaltung
GmbH)のGeneral ManagerであるHelmut Jeggleは次のように述べています。「固形がんのアンメットメディカルニーズへの新規の治療アプローチとなるGanymed社のポートフォリオを、ヘルスケア業界において卓越した能力を持ち献身的なプレイヤーであるアステラス製薬に託すことができ、嬉しく思います。」
Ganymed社は、2001年に設立された非上場のバイオ医薬品企業で、新規のがん治療薬の研究開発に注力しています。同社は、IMAB362を含み、がん領域に非臨床段階、臨床段階にある複数の開発品を有しています。Claudin18.2陽性の胃食道がん患者を対象として実施したIMAB362の第IIb相試験(FAST
study)における最新の結果では、標準的な化学療法にIMAB362を追加で投与した場合において、無増悪生存期間の中央値(7.9ヶ月vs.
4.8ヶ月、HR 0.47、p=0.0001)、及び全生存期間の中央値(13.2ヶ月 vs. 8.4カ月、HR
0.51、p=0.0001)の延長が認められました。またClaudin18.2が最も高いレベルで発現していた患者のグループでは、約2倍の全生存期間が認められました(16.7カ月
vs. 9.0カ月、HR 0.45、p<0.0005)。最も多く認められた有害事象は、嘔吐、悪心及び好中球減少でした。
なお、本買収によるアステラス製薬の通期(2017年3月期)連結業績への影響は現在精査中です。
買収の概要
株式取得者:アステラス製薬株式会社 Ganymed社の主要株主:ATS
Beteiligungsverwaltung GmbH、MIG Fonds、FCP Gany GmbH、Future Capital
AG 株式の取得方法:現金(手元資金を充当) 対価:
Ganymed社の全株式を取得するための契約一時金として4億2,200万ユーロ
臨床開発プログラムIMAB362の開発の進捗に応じ、最大で総額8億6,000万ユーロ
買収完了予定日:(必要な法的諸手続きを経て)数週間以内 アステラス製薬の財務アドバイザー:なし
アステラス製薬の法務アドバイザー:Latham & Watkins LLP Ganymed社株主の財務アドバイザー:klugeconcepts,
JP Morgan Ganymed社株主の法務アドバイザー:Freshfields
Bruckhaus Deringer, honert + partner
対象会社の概要
名称:Ganymed Pharmaceuticals AG 所在地:ドイツ マインツ 代表者:CEO Özlem Türeci 設立:2001年 資本金:1,416,308ユーロ(2016年5月末時点) 従業員数:85名
アステラス製薬との関係:対象会社との間には、記載すべき関係はありません。
IMAB362について
IMAB362は、細胞間接着の一つであるタイトジャンクションを形成する膜貫通型タンパク質Claudin18.2を標的とする抗体医薬品候補です。Claudin18.2は、正常細胞では胃細胞に局所的に発現している一方、胃腸腺がんの80%、すい臓がん、胆管がん、卵巣がん及び肺がんの60%と複数の癌で高発現していると言われています。IMAB362の作用機序は、抗体依存性細胞性細胞傷害(ADCC)活性、補体依存性細胞傷害活性(CDC)、及び化学療法薬との併用で腫瘍微小環境に対する免疫調節と考えられています。IMAB362は、米国及び欧州において、胃がん及びすい臓がんに対しオーファンドラッグの指定を受けています。
Ganymed社について
Ganymed Pharmaceuticals AGは、Ideal
Monoclonal Antibodies (IMABs)
と呼ばれる新規のがんに対する免疫療法の研究開発に注力するバイオ医薬品企業です。IMABsは、がん細胞に発現するタンパクに対して高い選択性を有する一方で、正常な細胞には結合しないことが特徴です。この特異性は、正常な細胞を傷つけることなくIMABsが結合したがん細胞のみを選択的に効率よく攻撃することができます。そのため、副作用を軽減した上で広い治療濃度域の最適用量を設定できることが期待されます。Ganymed社は2001年に設立された非上場の企業です。同社の主要株主はATS
Beteiligungsverwaltung GmbHであり、その他の株主はMIG Fonds、Future Capital AG、FCP
Gany GmbH及び個人株主になります。
2017年1月10日 アステラス製薬
UMNファーマとの細胞培養インフルエンザワクチンの共同事業契約解約のお知らせ
アステラス製薬は、UMNファーマと2010年9月21日付で締結した、細胞培養インフルエンザワクチンプログラムASP7374(UMN-0502)及びASP7373(UMN-0501)の日本での共同開発及び独占的販売に関する共同事業契約について、解約権を行使しましたのでお知らせします。
解約の発効日をもって、アステラス製薬は、共同事業契約に基づいてUMNファーマにより付与された全ての権利を同社に返還します。なお、アステラス製薬は、ASP7374の製造販売承認申請を取り下げ、ASP7373の開発を中止します。
アステラス製薬は、本件に関わるその他の無形資産の減損損失40億円を当期(2017年3月期)第3四半期に計上する予定です。その他の業績への影響については、現在精査中です。
UMNファーマは Unmet Medical Needs
を満たす薬剤を開発する創薬ベンチャーとして2004年に設立
BEVS(Baculovirus Expression
Vector
System)は人体に影響がないとされるウイルスに標的遺伝子情報を組み込んだ後、昆虫細胞に感染させて目的タンパク質を大量に製造する技術で、UMNファーマはヨトウガ由来の細胞株を用い、UMN-0501、UMN-0502を製造する。
------
UMN
平成26 年5月30 日付で厚生労働省に対してインフルエンザの予防の効能・効果にて製造販売承認を申請、独立行政法人医薬品医療機器総合機構(「PMDA」)による審査の過程において発出された各種照会事項への対応を継続してまいりました。
国内における本剤の臨床試験成績に加え、当社の技術導入元であるProtein
Sciences Corporationが既に米国で販売している季節性組換えインフルエンザHA ワクチンFlublok®(UMN-0502
と同薬)では既承認孵化鶏卵インフルエンザワクチンより優れた有効性試験成績の結果が得られていること及び米国での使用状況から、本剤の臨床的意義は高いと認識しております。
当社としては本剤の臨床的意義は高いと認識しており、再度の製造販売承認申請は可能と考えております。今後、再申請を行う上での要件及び必要なコスト・期間等を見積もった上で、方針を決定してまいります。
2010年6月22日
IHIとUMNファーマによるUNIGENの設立について ~インフルエンザワクチン原薬の製造会社の共同運営を開始~
IHIとUMNファーマは、両社の間で平成22年1月25日に締結した、細胞培養法を用いたインフルエンザワクチン原薬の製造事業に関する基本協定に基づき、このほど当該原薬の製造新会社、株式会社UNIGENを共同で設立致しました。
UNIGENは、UMNファーマが秋田県秋田市に建設中の細胞培養法によるインフルエンザワクチン原薬製造工場における生産業務を担当し、平成24年の生産開始を予定しています。
UNIGENは、新型インフルエンザワクチンに対し高まる迅速な供給ニーズに対応するため、UMNファーマの有するワクチン生産に関する知見・経験と、IHIの有するエンジニアリング技術を併せた相乗効果により、効率的な製造設備の運営を行うことを目指しています。
UMNファーマは、細胞培養によって産生される組換えタンパク製造技術を使用する、組換えインフルエンザHAワクチン(H5N1株)UMN-0501の第II相臨床試験を終了し、現在、第Ⅲ相臨床試験の準備を進めております。従来の発育鶏卵を用いて製造するインフルエンザワクチンは製造に少なくとも約6ヶ月を要するとされていますが、UNIGENが原薬の製造を担当するUMN-0501では、ワクチンが必要とされてから市場に供給できるようになるまでの期間を約2ヶ月と、大幅に短縮できます。
IHIは、本事業を社会的意義の大きい事業と捉え、UNIGENの運営を共同で行うことで、自社の技術を社会の安全・安心の確保に役立てるよう努めてまいります。本事業は、IHIの中期経営計画である、「グループ経営方針2010」で成長・注力事業と位置づけている医薬プラント事業において、IHIグループで蓄積しているエンジニアリング技術を中核に、細胞培養に係る製造技術や要素技術等の融合を図り、プラント本体の販売に留まらない高付加価値製品の生産に拡げていきます。
UNIGEN代表取締役社長 平野 達義は次のように述べております。「昨年の新型インフルエンザ(A/H1N1)の発生を例にとっても、新型インフルエンザの発生・流行に備え、必要とされるワクチンを、より迅速に製造できる体制を日本国内に確保することが喫緊の課題になっています。UMNファーマが開発中の組換えインフルエンザHAワクチンの原薬製造体制を可能な限り早期に構築することで、国民の保健衛生の向上に寄与できるよう全力で取り組みます。」
株 主 : UMNファーマ 40,200株(50.25%)→50%
IHI 39,800株(49.75%)→50%
----------
IHI 今後の対応について急ぎ検討してまいります。
事業の継続が難しいと判断し、撤退を含め検討する。
IHIはUNIGENの製造設備資金や運転資金の一部を債務保証しており、2016年12月末時点の残高は110億円。今後、回収の可能性を見直し、損失が発生する可能性がある。
2017年4月3日
ベルギー Ogeda社買収に関する契約締結契約一時金5億ユーロ を支払い、更に、fezolinetantの開発の進捗に応じて、最大で総額3億ユーロ を支払う可能性があります。今後、アステラス製薬は米国のHart-Scott-Rodino法で定める待機期間が終了することなどの前提条件や、必要な法的諸手続きを経て、2017年度第1四半期中に買収を完了し、Ogeda社を完全子会社化する予定です。
2017年10月30日
アステラス製薬、マラリア治療薬の探索に関するMedicines for Malaria
Ventureとの共同研究契約締結
アステラス製薬は、最先端のマラリア治療薬の研究開発を行う製品開発パートナーシップであるMedicines for Malaria
Venture(「MMV」)と、新規マラリア治療薬の探索に関する共同研究契約を締結しましたのでお知らせします。今回開始する研究プログラムは、公益社団法人グローバルヘルス技術振興基金(「GHIT
Fund」)およびMMVから資金提供を受けて実施します。
本契約に基づき、アステラス製薬は独自に保有する数万に及ぶ化合物ライブラリーをMMVに提供し、MMVは、オーストラリア
ブリスベンのGriffiths UniversityのVicky
Avery教授と協働で新規のマラリア治療薬の研究・開発候補化合物の創製に向けた化合物のスクリーニングを行います。
マラリアは、マラリア原虫によって引き起こされる疾患で、マラリア原虫を保有した雌のハマダラカに刺されることで人に感染します。2015年には全世界で2億人以上がマラリアに罹患し、42万人以上の命が失われました。2016年には、マラリア患者と、感染による死亡者の90%以上がアフリカ諸国をはじめとした91の国と地域で発生し、さらにマラリア治療に最も使用されているアーテミシニンに対する耐性がメコン地域では問題となっており、画期的な新薬が望まれています。
本研究プログラムに資金提供をするGHIT
Fundは、HIV/AIDS、結核、マラリア、顧みられない熱帯病等、特に開発途上国の人々を苦しめる感染症の制圧を目指し、日本の技術、知見、イノベーションを用いた治療薬、ワクチン、診断薬の開発を目的として設立された国際的な非営利団体です。アステラス製薬は、GHIT
Fundの発足以来5年間にわたり資金拠出を行ってきましたが、その活動の第二期となる2018年度から2022年度までの5年間においても、さらにGHIT
Fundに資金拠出することを決定しています。
アステラス製薬は、本共同研究への取り組みおよびGHIT
Fundへの継続的な参画を通じて保健医療へのアクセス(Access to Health)課題の解決に取り組んでいきます。
Medicines for Malaria Ventureseven new medicines :
Furthermore, with MMV support,
Cipla’s rectal artesunate (RAS) product was issued a 12-month authorization for
procurement by the Global Fund Expert Review Panel (ERP), while regulatory/WHO
prequalification review is ongoing for the same product as well as that of
Strides Shasun. In addition, MMV has taken over the stewardship of two approved
artemisinin combination therapies (ACTs) developed by Drugs for Neglected
Diseases initiative (DNDi) and partners – artesunate-amodiaquine (ASAQ) and
artesunate-mefloquine (ASMQ).
2018年08月10日
アステラス製薬 英国 Quethera社買収のお知らせ
- 緑内障を対象とした革新的な遺伝子治療プログラムを獲得 -
アステラス製薬は、本日、Quethera
Limited(本社:英国ケント州)を買収しましたので、お知らせします。Quethera社は、緑内障など眼科領域における新規の遺伝子治療の開発に注力する英国のバイオベンチャー企業です。
緑内障:
視神経の損傷が進行していく病気で(眼圧の上昇を伴うことが多いが、常に伴うわけではない)、不可逆的な視力障害につながる疾患です。現在行われている治療は、眼圧を低下させる薬物療法、レーザー治療、手術など、進行を遅らせる治療法が中心です
本買収により、アステラス製薬は緑内障患者の網膜に治療遺伝子を発現させる遺伝子組換えアデノ随伴ウイルス(recombinant
adeno-associated viral vector system: rAAV)を活用した遺伝子治療プログラムを獲得します。rAAVプログラムは、前臨床試験において網膜神経節細胞の生存率の改善が確認されています。
アステラス製薬の代表取締役社長CEOの安川健司は、「本買収は、最先端の科学、技術を積極的に取り込み、患者さんの価値に変えていくというアステラス製薬の戦略に基づく取り組みです。眼圧のコントロールに依存しないユニークな作用メカニズムを有するrAAVプログラムは、難治性の緑内障の治療選択肢となる可能性があります。本プログラムが、視力を失うリスクのある緑内障患者さんのアンメットメディカルニーズに応える治療法となることを期待しています」と述べています。
Quethera社CEOのPeter
Widdowsonは、「Quethera社は、患者さんの失明につながり、生活の質(Quality
of Life: QOL)を著しく低下させる緑内障などの眼科疾患に対する革新的な治療法の開発に注力しています。本買収により、rAAVプログラムの有効性を確認するための研究が一層加速していくことを期待しています」と述べています。
アステラス製薬は、Quethera社を100%子会社化するための対価として、一時金およびあらかじめ契約で定められた条件に基づく支払いを合わせ、最大で85百万ポンドをQuethera社の株主に支払う可能性があります。
買収手続きはすでに完了しており、Quethera社はアステラス製薬の完全子会社となりました。
なお、本件によるアステラス製薬の2019年3月期業績への影響は軽微です。
記
買収の概要
(1)
株式取得者:アステラス製薬株式会社
対象会社の概要
(1)
名称:Quethera Limited
2018年12月14日
アステラス製薬は、米国のがん免疫関連バイオテクノロジー企業Potenza
Therapeutics,
Inc.との間で2015年に締結した独占的共同研究開発契約に基づきPotenza社を買収する独占的オプション権を行使 し、米国東部時間12月13日にアステラス製薬による買収手続きが完了しましたので、お知らせします。Potenza社との提携により創出した臨床段階にある複数の新規がん免疫療法プログラム は、アステラス製薬が保有する既存のがんプログラムとの併用療法や、新たながん免疫療法プログラムとの併用療法の開発につながる可能性があります。
アステラス製薬の代表取締役社長CEOの安川健司は、「本買収は、最先端の科学、技術を取り込み、患者さんに価値をもたらす革新的な医薬品を創出していくというアステラス製薬の戦略に基づく取り組みです。私たちは、新たな作用機序やモダリティを用いて、がん領域のアンメットメディカルニーズを満たすための研究開発に注力しています。Potenza社と創出した新規がん免疫療法プログラムは、既存のがん免疫療法では十分な効果が得られなかった患者さんにとって新たな治療選択肢となる可能性があります」と述べています。
過去3年半にわたる共同研究開発提携により、アステラス製薬とPotenza社は、免疫刺激、免疫チェックポイント阻害および制御性T細胞機能をターゲットとする、以下の3種類の新薬候補プログラムを創出しました。
抗TIGIT抗体(免疫チェックポイント阻害薬)ASP8374/PTZ-201および抗NRP1抗体(Treg機能阻害薬)ASP1948/PTZ-329は、第I相試験実施中です。 GITR作動性抗体(T細胞プライミングおよび共刺激)ASP1951/PTZ-522は、新薬臨床試験開始申請が承認されました。
本買収により、Potenza社はアステラス製薬の完全子会社となり、アステラス製薬は競争力のある自社のがん免疫療法プログラムを獲得しました。
Potenza社のPresident and CEOであるDan Hicklin,
Ph.D.は、「がんに対する革新的な医薬品を創出するために、経験豊富なPotenza社の研究チームが成し遂げたことを誇りに思います。過去3年半にわたり、私たちはアステラス製薬との良好なパートナーシップのもとで共同研究を続けてきました。今後、がん患者さんのために、これらの革新的な新薬候補の開発をグローバル企業であるアステラス製薬が有する世界レベルの研究開発力と戦略面・資金面での後押しを受けて進められることを大変嬉しく思います」と述べています。
本オプション権の行使により、アステラス製薬は164.6百万ドルを対価として支払いPotenza社を買収しました。さらに、Potenza社の臨床開発段階にある複数のプログラムの進捗に応じて、Potenza社の株主に対し、最大で総額240.1百万ドルの対価の支払いが発生する可能性があります。
なお、本買収によるアステラス製薬の当期(2019年3月期)連結業績への影響は精査中です。
記
買収の概要
株式取得者:アステラス製薬株式会社
Potenza社の主要株主:MPM Capital, InterWest
Partners, アステラス製薬株式会社、同社設立者等(ストックオプションを含む)
株式の取得方法:現金(手元資金を充当)
対価:Potenza社をアステラス製薬の完全子会社とするための対価として164.6百万ドル。さらにPotenza社の臨床開発段階にある複数のプログラムの進捗に応じて最大で総額240.1百万ドル
対象会社の概要
名称:Potenza Therapeutics, Inc.
所在地:米国マサチューセッツ州ケンブリッジ
代表者:President and CEO Dan J. Hicklin, Ph.D. 設立:2014年 従業員:19名
アステラス製薬との関係:持分法適用会社であり、共同研究提携先
説明会
資料 米国 Audentes社買収に関する契約締結および株式公開買付けの開始予定に関するお知らせ
-遺伝子治療分野でのリーディングポジション確立に向けた重要なステップ-
-リードプログラムのAT132が第I/II相臨床開発段階-
-2020年の第1暦四半期に買収完了予定。Audentes社を完全子会社化-
アステラス製薬は、米国のバイオテクノロジー企業 Audentes Therapeutics,
Inc.との間で、アステラス製薬がAudentes社を買収することで合意し、12月2日(日本時間)に契約を締結しました。
本公開買付けは、Audentes社が発行済みの全ての普通株式を一株当り60.00米ドルの現金を対価として取得するものです。これは、Audentes社株式の2019年12月2日終値(28.61米ドル/株)に対して110%のプレミアムを加えた価格となり、総額は約30億米ドルとなります。また、Audentes社の取締役会は、本公開買付けへの応募をAudentes社株主に推奨する旨の決議をしています。
(1) 本買収の目的
アステラス製薬は、「Focus Area
アプローチによる価値創造」を経営計画2018における戦略目標の一つに掲げ、バイオロジーとモダリティ/テクノロジーの独自の組み合わせを見出し、アンメットメディカルニーズの高い疾患に対する革新的な医薬品の創出を目指しています。現在、4つのPrimary
Focusを特定し、優先的に経営資源を投下していますが、「遺伝子治療」をそれらに続く有望なPrimary
Focus候補と位置付け、遺伝子治療薬の研究開発に取り組んでいます。
Audentes社は、希少かつ重篤な神経筋疾患を対象に、アデノ随伴ウイルス(AAV)に基づく遺伝子治療薬の研究開発に注力する バイオテクノロジー企業であり、AAVを活用した独自の遺伝子治療薬の技術プラットフォームや治療薬を自前で製造することができる高い能力を有しています。また、有望な遺伝子治療プログラム群からなるパイプラインを構築しており、特に、X染色体連鎖性ミオチュブラー・ミオパチー(XLMTM)を対象とするAT132は、同社のリードプログラムとして現在、第I/II相臨床開発段階にあります。
Audentes社の買収は、Focus
Area
アプローチを一層推進し、遺伝子治療を当社の新たな成長領域に進化させていくための重要なステップです。本買収の戦略的意義は以下の通りです。
極度の筋力低下、呼吸不全および早期の死亡という特徴を有する重篤で生命に関わる希少な神経筋疾患であるXLMTMを対象に開発されているAT132による、近い将来における当社の成長機会の獲得 Audentes社のAAVに基づく遺伝子治療薬の技術プラットフォーム、大規模な自社製造能力および神経筋疾患の研究開発に関する知見と、アステラス製薬の研究開発力およびグローバルでの事業基盤を融合させることにより、遺伝子治療プログラムの強固なパイプラインの構築と開発のスピードアップ Audentes社の製造能力、患者団体や学術的なパートナーなどとの貴重な人的ネットワークの取り込みによる、遺伝子治療の領域におけるパートナリングやパイプライン拡大の機会創出
アステラス製薬の代表取締役社長CEOである安川
健司は、「遺伝子治療の分野における科学的・技術的な革新により、患者さんにこれまでにない持続的価値がもたらされ、さらには一回の治療で疾患を根本的に治療できる可能性が高まっています。Audentes社は、XLMTMを対象とするリードプログラムのAT132をはじめ私たちのパイプラインを補完する有望なプログラム群を有しています。当社は今後、Audentes社の優れたチームとともに、希少かつ重篤な疾患を有する患者さんのアンメットメディカルニーズに応えていくために、遺伝子治療の領域においてリーディングポジションを確立していきます」と述べています。
また、Audentes社の
Chairman and CEO である Matthew R. Patterson
は「このたびのアステラス製薬との契約合意を大変嬉しく思います。革新的な科学にフォーカスし、研究開発から商業化までのグローバルネットワークを有するアステラス製薬の一員となることで、私たちは遺伝子治療プログラムの開発を着実に進展させ、患者さんに貢献することができると確信しています」と述べています。
(2) 二段階買収に関する事項
本公開買付け終了後、Asilomar社とAudentes社は、Audentes社を存続会社として合併し、Audentes社は当社の連結子会社となる予定です。
2. 本公開買付け等の概要
(1) 買付期間(予定)
最初の買付期間は、今後数週間以内に開始され、開始後 20 営業日で終了します。
(2)
買付けを行う株券等の種類
普通株式
(3) 買付価格
普通株式 1
株あたり60.00米ドル
(4) 買付けに要する資金
約30億米ドル
(5) 買付けの条件
本公開買付けは、米国独占禁止法に基づく承認、およびAudentes社の発行済普通株式の
50%超の株式が応募されること、その他同種の取引に通常規定される各種条件を満たすことを前提に行われます。
(6) 下限応募株式数
公開買付者は、Audentes社の発行済普通株式の
50%超の株式の応募があった場合に買付けを行います。
3.
本公開買付けによる当社保有の Audentes社株式数の異動
本公開買付け前保有株式割合 0%
4. 対象会社の概要
①名称
Audentes Therapeutics, Inc.
②所在地
600
California Street, 17th Floor, San
Francisco, CA 94108, US
③代表者の役職・氏名
Chairman and CEO: Matthew R.
Patterson
④事業内容
遺伝子治療技術を活用した医薬品の研究開発
⑤連結純資産
383,459千米ドル(2019年9月30日時点)
⑥設立年
2012年設立
⑦発行済株式総数
45,857,989 株(2019年11月29日時点)
⑧上場会社と対象会社の関係
資本関係:
当社と対象会社の間には、記載すべき資本関係はありません。
人的関係:
当社と対象会社の間には、記載すべき人的関係はありません。
取引関係:
当社と対象会社の間には、記載すべき取引関係はありません。
関連当事者への該当状況
対象会社は当社の関連当事者には該当しません。
⑨対象会社の最近3年間の連結経営成績および連結財政状態(**)
決算期
2016年12月期
2017年12月期
2018年12月期
連結純資産(千米ドル)
119,371
156,598
442,754
連結総資産(千米ドル)
142,057
178,662
472,555
連結売上高(千米ドル)
-
-
-
連結当期純利益
(59,668)
(90,238)
(128,821)
** Audentes社が米国取引委員会
(SEC)に提出した Form 10-K から引用
5. 今後の見通し
本公開買付けおよび本買収による当社の通期(2020 年 3
月期)連結業績への影響については、現在、精査中です。
6. 財務および法務アドバイザーについて
当社の財務アドバイザーは
三菱UFJモルガン・スタンレー証券株式会社/Morgan Stanley & Co.
LLC、法務アドバイザーは Covington & Burling LLP です。
本公開買付けに関する詳細情報については、米国証券取引委員会(SEC)のウェブサイト( http://www.sec.gov )に掲載される予定です。
ーーーーーーーーーーーーーーー
日経
アステラス製薬は3日、医療系スタートアップの米オーデンテス・セラピューティクス(カリフォルニア州)を約30億ドル(約3200億円)で買収すると発表した。希少疾患向けの遺伝子治療技術 を取得する狙い。アステラスは買収を通じて新たな遺伝子治療技術を手に入れるとともに、今後、米国を中心に希少疾患領域での事業拡大を進めたい構えだ。
数週間以内にオーデンテス社の発行済み株式のすべてをTOB(株式公開買い付け)し、約20日間で終了する予定。取得価格は1株60ドルと、オーデンテス社の2日の終値(28.61ドル)の約2.1倍となる。
オーデンテス社は2012年創業のバイオスタートアップ企業で、主に遺伝子の運び手となるアデノ随伴ウイルス(AAV)を使った遺伝子治療技術 に強みを持つ。アステラスは自社のノウハウにオーデンテス社の技術を融合させ、開発をスピードアップさせたい考えだ。
遺伝子治療薬は病気の原因部分に治療遺伝子を直接届ける仕組み。長期間にわたって治療効果が続くため、次世代医薬品の本命として開発が加速している。
遺伝子治療を巡っては18年にスイスのノバルティスが米アベクシス社を87億ドルで買収したほか、19年2月にはスイスのロシュが米スパーク・セラピューティクスを買収することで合意したと発表した。米
Pfizer も3月に仏バイオベンチャー、
の株式15%を4500万ユーロ(約55億円)で取得 すると発表するなど、大手製薬による買収が相次いでいる。
2018/4/26
Novartis、遺伝子治療薬開発の AveXis
を買収
スイス製薬大手Rocheは2019年2月25日、遺伝子治療薬を手がける米Spark
Therapeutics を買収することで合意したと発表した。買収額は43億ドル。(Luxturna) の承認を得た。ラクスターナは希少な目の遺伝病に対する治療薬で85万ドルの薬価設定も話題となった。
米スパークの網膜の難病向け遺伝子薬「ラクスターナ」は両眼で85万ドル(約9300万円)、アベクシスの乳幼児の遺伝子難病の治療薬「ゾルゲンスマ」は212万ドル(約2億3000万円)と超高額な薬価が話題になった。日本では大阪大学発スタートアップ、アンジェスが開発した遺伝子治療薬「コラテジェン」が8月に国内で初めて承認されている。
2019年12月27日 アステラス製薬
Xyphos
Biosciences, Inc.買収に関するお知らせ
- Xyphos社の人材および技術プラットフォームを獲得することにより、次世代がん免疫療法の研究開発をさらに加速
-
アステラス製薬は、Xyphos Biosciences,
Inc.(米国カリフォルニア州)との合意に基づき、米国子会社を通じてXyphos社の発行済み全株式を取得することにより、米国太平洋時間12月26日に買収しました。本買収により、アステラス製薬は、Xyphos社が有するCAR(Chimeric
Antigen
Receptor:キメラ抗原受容体)-細胞療法に関する技術プラットフォームであるACCELTM (Advanced
Cellular Control through Engineered Ligands)とともに、がん免疫の分野をリードする優秀な人材を獲得することになります。
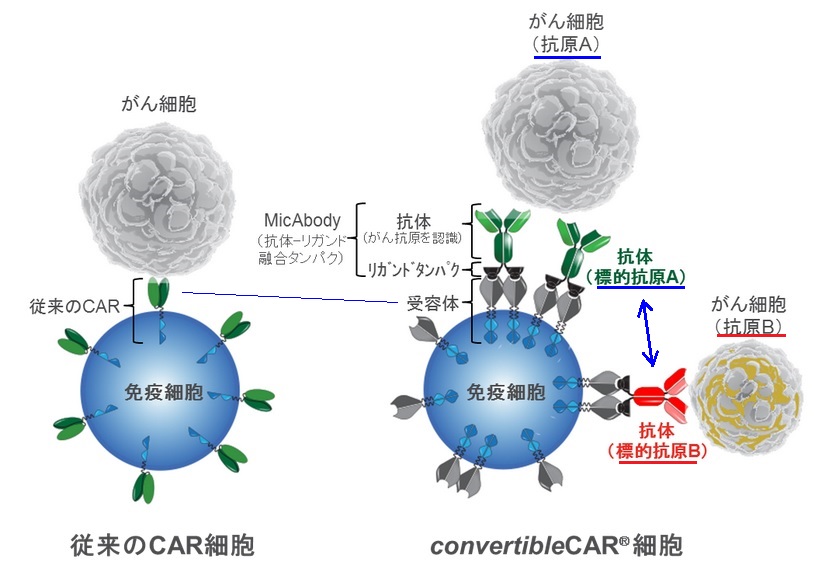
Xyphos社独自のACCELTM 技術は、タンパク工学により創製した受容体とリガンドタンパクの特異的な結合を利用した合成生物学的手法に基づいています。受容体を発現させたナチュラルキラー(NK)細胞やT細胞といった免疫細胞(convertible CAR® 細胞) と、攻撃標的であるがん抗原を認識する抗体 をリガンドタンパクと融合 させた抗体-リガンド融合タンパク(MicAbody)を患者さんに投与し、治療する技術です(下図参照)。
攻撃対象となるがん細胞の特徴に応じて、MicAbodyを取り替えたり、複数使用することで、convertible CAR® 細胞に異なるがん抗原や複数のがん抗原を認識させ、 様々ながん細胞を攻撃することができます。*1 の発生を抑制できることも期待されます。
サイトカイン 放出症候群 : CAR - T 療法下で見られる 有害事象 の一つで、過剰な免疫反応に より 多量のサイトカインが放出され 、血中のサイトカイン濃度が高度に上昇すること により 起こり ます。インフルエンザ様症状(発熱、悪心・悪寒、筋肉痛 等) 、 重度の低血圧、頻脈、呼吸困難など の 症状が急激に進展すると死亡に至ることがあります。
さらに、MicAbodyの抗体部分を別のタンパクに替えることにより、convertible CAR® 細胞の増殖や生存制御も可能になります。
Xyphos社のconvertible CAR® -T細胞のリードプログラムは現在、前臨床開発段階にあり、2021年に初めての臨床試験が行われる予定です。今後、アステラス製薬の子会社であるUniversal
Cells社が有するユニバーサルドナー細胞技術と組み合わせ、白血球型抗原(HLA)不適合による拒絶を抑えた多能性幹細胞からconvertible CAR® 細胞を作製することで、多くの患者さんの治療に用いることが可能な革新的CAR-細胞医療製品が創製できると期待しています。
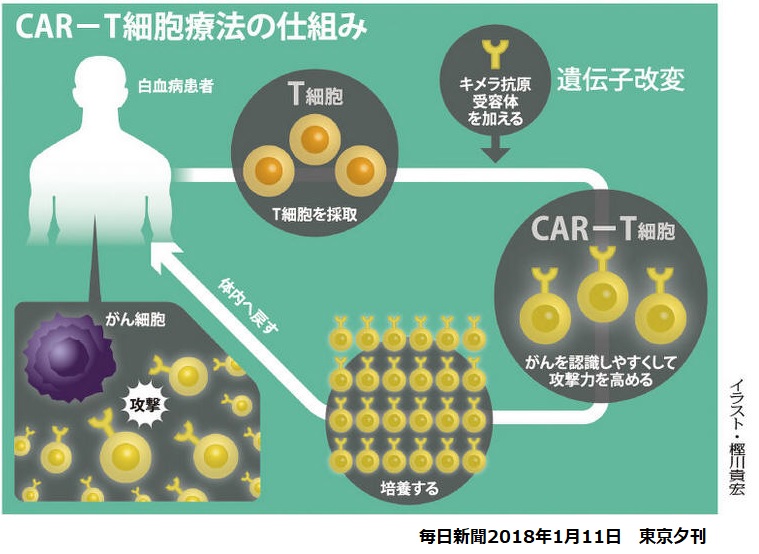
CAR-T細胞治療は、患者由来の免疫細胞(T細胞)の遺伝子組み換えを行い、がん細胞を捉えて攻撃しやすくした上で患者の体内に戻す免疫細胞医療で、治療法が確立していない重篤・致死的な疾患に対する治療法として期待されている。
厚生労働省は2月20日、薬事・食品衛生審議会
再生医療等製品・生物由来技術部会を開催し、ノバルティスファーマの「キムリア点滴静注」(チサゲンレクルユーセル)を 国内初のCAR-T細胞医療 として正式承認することを了承した。2019年3月26日に承認取得。
米国で2017年8月30日、 再発・難治性(r/r)B
細胞性急性リンパ芽球性白血病(ALL)の小児および若年成人患者を対象とするCAR-T療法の
CTL019(商品名 Kymriah)が米FDAの承認を得た。
CAR-T細胞療法では日本では、第一三共が米国Gilead
Scienceの大細胞型B細胞リンパ腫 を対象に申請準備中であるほか、大塚製薬やセルジーンが開発を行っている。
2019/2/22 厚労省部会、国内初の遺伝子治療2品目の承認を了承
アステラス製薬の代表取締役社長CEOである安川健司は、「アステラス製薬では、がん免疫を研究開発戦略上のPrimary
Focusのひとつに位置づけ、新たなモダリティ/テクノロジーによる次世代のがん免疫治療法の開発に取り組んでいます。Xyphos社が有する革新的な技術は、がん免疫領域において患者さんに価値をもたらす革新的な治療法を創出することを目指す私たちの戦略に合致するものです。この技術をこれまで培ってきた再生・細胞医療のケイパビリティと組み合わせることにより、がん免疫における次世代高機能細胞の創製が可能となり、技術価値を最大化することができると確信しています。私たちは、今後、Xyphos社の優秀なチームとともに、研究開発プログラムを進展させ、がん免疫パイプラインをさらに強固にしていきます」と述べています。
Xyphos社のCEOであるJames
Knightonは、「私たちは、がんの治療や治癒につながる可能性のある革新的な技術プラットフォームの開発を進めてきました。がん免疫に注力するアステラス製薬は、NK細胞およびT細胞の活性化を制御する技術プラットフォームから得られた治療薬候補を臨床開発へ進めていくための理想的なパートナーです。私たちは今後、アステラスグループの一員として、活気溢れるサウスサンフランシスコ地域において、がん免疫の研究開発をさらに加速させていくことを楽しみにしています」と述べています。
買収の対価として、買収手続完了時に1億2,000万ドル が支払われ、Xyphos社はアステラス製薬の完全子会社となりました。当該支払いと、開発の進捗に応じたマイルストン支払いを合わせ、最大で総額6億6,500万ドル が支払われる可能性があります。
買収の概要
対象会社の概要
2023年01月10日
アステラス製薬とSelecta Biosciences社 IgGプロテアーゼXork
の独占的ライセンスおよび開発に関する契約締結のお知らせ 提携
アステラス製薬は、Selecta
Biosciences,
Inc.(本社:米国マサチューセッツ州)と、IdeXork(Xork)の独占的ライセンスおよび開発に関する契約が締結されたことをお知らせします。Xorkは、Selecta社が研究中の次世代免疫グロブリンG(IgG)プロテアーゼ で、遅発型ポンペ病の成人患者を対象 に開発中のアデノ随伴ウイルス(AAV)遺伝子治療プログラムAT845と併用する候補としてアステラス製薬が開発を進めます。
ポンペ病は、特定の酵素(酸性α-グルコシダーゼ)が欠損または活性が低下することにより、ライソゾーム内にその基質であるグリコーゲンが進行性に蓄積することで生じる先天性代謝異常症です
。
遅発型 では、近位筋筋力低下、呼吸筋筋力低下、高CK血症、翼状肩甲などが認められます。
Selecta社のCarsten
Brunnは、「現在、多くの患者さんがAAV遺伝子治療の臨床試験の適格基準を満たしません。これは、遺伝子治療用AAVカプシドに反応する抗体を自然と獲得してしまっているためです。Xorkは、この獲得済み抗体の問題を解決し、遺伝子治療へのアクセスを拡大する可能性を持っています。現在開発中の他のほとんどのIgGプロテアーゼは一般的なヒト病原体に由来するため、当該プロテアーゼに対する抗体をすでに保有している患者さんが多くいると考えられ、その使用が制限される可能性があります。Xorkは、ヒト血清中の既存抗体に対する交差反応性が低いことで差別化されています。強固な遺伝子治療ポートフォリオの臨床応用を推進するアステラス製薬と提携できることを大変嬉しく思います」と述べています。
アステラス製薬の代表取締役副社長
経営戦略担当の岡村直樹は、「私たちは、治療の選択肢が限られた病気とともに生きるより多くの患者さんに、新たな治療の選択肢を提供するため、Selecta社と提携できることに期待しています。この提携は、私たちの遺伝子治療プログラムの臨床試験または治療の対象とはならない可能性のある特定層の遅発性ポンぺ病の成人患者さんに対して、革新的な遺伝子治療を提供する機会をもたらす可能性があります」と述べています。
本契約に基づき、Selecta社は契約一時金として1,000万米ドルを受け取ります。さらに、Selecta社は、開発および商業化のマイルストンに応じて最大3億4,000万米ドルと、XorkをAT845と併用した場合の製品の売上に応じたロイヤリティを受け取る可能性があります。Selecta社はXorkの開発と製造を担当し、ポンペ病以外の追加適応症の開発の権利を維持します。アステラス製薬は、ポンぺ病に関し、AT845など遺伝子治療プログラムの治験薬および製品と併用する用途において、Xorkを商業化する単独かつ独占的な権利を有します。
本件によるアステラス製薬の通期(2023年3月期)連結業績への影響は軽微です。
本件は、米国において現地時間1月9日に対外発表しています。
以上
アステラスが米バイオ企業買収 8000億円、眼科向け拡充
202 3
年
5
月
1
日
ア
ス
テ
ラ
ス
製
薬
米国
I veric
Bio
社買収に関する契約締結 の お知らせ
- 眼科 領域の最先端に立つバイオ医薬品企業 -
- 米国で承認申請中の リードプログラム
Avacincaptad Pegol
の 審査終了目標日 は
8
月
19
日 -
- Primary
Focus 「再生と 視力の維持・回復 」 を 加速 -
- 買収価格は、一株当たり
40 .00
米ドル、総額約
5 9
億 米ドル -
アステラス製薬 は 、 米国のバイオ 医薬品 企業
IVERIC bio,
Inc. ( 本社:米国 ニュージャージー 州 との間で 、 アステラス製薬 の 米国持株 子会社アステラス
US
ホールディング
Inc. (本社:米国イリノイ州) の
100% 子会社で ある
Berry Merger Sub, Inc. を通じて、 一株当 た り
40 .00
米ドル、総額約
5 9
億 米 ドル の現金を対価として
IVERIC
社 を買収 することで合意し、 4
月
2 9 日(日本時間)に契約を締結し ま した 。
本買収において、 IVERIC
社 は アステラス製薬が間 接的に保有する
100% 子会社となる予定です。 合意した取得価格は
Iveric Bio
社 の潜 在株式を含む発行済み普通株式数約
148. 2 百万 株との前提に基づいて おり、 Iveric Bio
社 株式の
2023
年
3
月
31
日 の 終値( 2 4. 33
米ドル/株)に対して
6 4 % 、 同日 から 過去
30
日間の売買高加重平均価格に対しては
75 % のプレミアムを加えた価格と なり ます。
アステラス製薬と
Iveric Bio
社 の取締役会は、 全会一致で 本 買収 へ 賛同し ています 。
アステラス製薬の代表取締役社長
CEO
である岡村
直樹は、「このたび、眼科領域に おける革新的な治療薬の研究開発について卓越した専門性を有する
Iveric Bio
社 と 買収契約の合意ができたことを大変うれしく思います。 Iveric
Bio
社 は 地図状 萎 縮 (
Geographic
Atrophy:
GA
) を 伴う加齢黄斑変性(
Age - related
Macular
Degeneration: AMD ) を対象 とするリードプログラム
Avacincaptad Pegol ( ACP ) をはじめとした有望なプログラム、および眼科領域に お ける バリューチェーン全 体に渡るケイパビリティを有しています。この買収により、失明リスクの高い眼科疾患に 罹患している患者さんへより大きな『価値』を届けることができると確信しています」と 述べています。
Avacincaptad pegol sodium
アバシンカプタドペゴルナトリウム 加齢黄斑変性治療薬
地図状 萎 縮(
Geographic
Atrophy:
GA
)を伴う加齢黄斑変性(
Age - related
Macular
Degeneration: AMD ) について
加齢黄斑変性( AMD )は、高齢者における中等度から重度の中心視力低下の主な原因であり、患者 さん の 大半は両目を侵されています。黄斑は網膜の中心部にあ るわずかな 領域で、中心視力を つかさど っていま す 。 AMD
が進行すると、黄斑部の網膜 上皮 細胞とその下 部 にある血管が失われ、網膜組織が著しく薄く なったり、萎縮したりします。 地図 状 萎縮 ( G A ) を伴う
A MD
は、患者さんの視力を不可逆的に低下させ 、高 いアンメットメディカルニーズがあります。 米国では 約 1 6 0万人が片目に
G A
を発症しているとされていま す * 1 。
Iveric Bio
社 の
CEO
である
Glenn P. Sblendorio
は、「 世界的に有名な アステ ラス製薬と 買収 契約 を 締結 できたこと は、 Iveric
Bio
社 が株主のために築いてきた大 きな価値を示 しており 、 Iveric
Bio
社 員によるこれまでの多大な功績を評価するもの です。 Iveric
Bio
社 の 眼科 領域における専門 性と ケイパビリティ、アステラス製薬のグ ローバル ビジネス における ケイパビリティ を掛け合わせ ることで、 GA
を伴う
AMD
を含 む、失明性の網膜疾患に苦しむ世界中の患者さんへ貢献していきます」と述べています。
本買収の目的
アステラス製薬は、 VISION 「変化する医療の最先端に立ち、科学の進歩を患者さん の 『 価値 』 に変える」の実現に向け、最先端の「価値」駆動型ライフサイエンス・イノベー ターを目指しています。 研究開発戦略である
Focus Area
アプローチ として、 多面的な 視点でバイオロジーとモダリティ/テクノロジーの独自の組み合わせを見出し、アンメッ トメディカルニーズの高い疾患に対する革新的な医薬品の創出 に取り組んでいます 。現 在、「再生と視力の維持・回復」を含む
5
つの
P rimary
Focus
を特定し、優先的に経営 資源を投下しています。 本買収は、アステラス 製薬 が掲げる重点領域における製品ポー トフォリオ構築のための重要なステップとなります。
Iveric Bio
社 は、 眼科領域に おいて 新規 治療薬 の研究 開発 に注力しています 。 ACP は、 地図状 萎 縮 GA
を伴う
加齢黄斑変性 AMD
を対象とし 、 米国で承認申請中で あり 、 米国食品医薬品局( FDA ) から優先審査指定を受け、 F DA
による審査終了目標日( PDUFA
date )は
2023
年 8
月
19
日です。
補体因子C5阻害剤である
ACP
は、 GAを伴う
AMD
の治療薬候補であり、十分な治 療を受けていない多くの患者さんに価値を提供できる可能性があります。 ACP
は、こ れまでに
2
つのピボタル試験 ( GATHER1,2
試験) において、主要評価項目( GA
の進 行抑制)を統計学的に有意に達成し、この適応症 について
FDA
から ブレークスルーセラ ピー指定
(Breakthrough Therapy Designation) *1
を受けています。
Iveric Bio
社 の リードプログラムである
ACP
を獲得すること が、アステラス製薬の 経営計画
2021
で定める
2025
年度までの売上 目標に貢献する だけでなく、 ACPは、 f ezolinetant
や
P ADCEV
とともに収益を生み出す柱と して 、 2020
年 代 後半に控 える
X TANDI
の 独占期間 満了 による 売上減少を 補 うことが 期待 されています 。
また、 Iveric
Bio
社 の買収により、アステラス製薬は、コマーシャルチーム や 、 専門家 との広範なネットワーク 、医療機関 とのパートナーシップ を含む 、 眼科領域における基盤 ケイパビリティ を 獲得 します 。このようなケイパビリティ獲得を通じて、 アステラス製薬 は 、 Primary
Focus 「再生と視力の維持・回復」における 目標達成 に向け、 臨床開発・市場 アクセスを加速させていきます。
、 手元資金に加えて、 銀行借入れ とコマーシャル ・ ペーパー の 発行 に よる 計 約
8 ,000
億円の 新規 調達資金を充当する予定です。 今後、 5 - 7
年 以内 に 返済 可能とみて い ます 。 なお、資金調達は本買収が成立するための条件とはなっていません。
また、 アステラス製薬のキャピタルアロケーションの方針に変更はありません。
本買収の完了は、 Iveric
Bio
社 の既存株主 や 独占禁止法関連の 当局の承認、 および その他のクロージング条件の充足を前提としています。 両社は、 2023
年度第
2
四半期 中 の買収 完了 を 見込 んでいます 。
①
名称
IVERIC bio, Inc.
②
所在地
8 Sylvan Way Parsippany
, NJ 07054, US
③
代表者の役職・氏名
CEO,
Glenn P. Sblendorio
④
事業内容
医薬品の研究開発
⑤
資本金
137 千米ドル( 20 22 年 12 月 3 1 日時点)
⑥
連結純資産
534,657 千米ドル( 20 22 年 12 月 3 1 日時点)
⑦
設立年
200 7 年
⑧
発行済株式総数
137,616, 08 2 株
( 2023 年 4 月 2 7 日時点)