2007年5月16日 田辺製薬/三菱ウェルファーマ
田辺三菱製薬株式会社の企業理念と目指す姿、シンボルマークおよび経営目標等の策定について http://www.tanabe.co.jp/newsrelease/2007/20070516.pdf
田辺製薬株式会社(代表取締役社長
葉山
夏樹、以下「田辺製薬」)と三菱ウェルファーマ株式会社(代表取締役社長
小峰 健嗣、以下「三菱ウェルファーマ」)は、両社それぞれの定時株主総会(田辺製薬6
月26 日、三菱ウェルファーマ6 月22
日開催予定)の承認を前提に、本年10 月1
日に合併し、田辺三菱製薬株式会社(以下「田辺三菱製薬」)として発足する予定です。
説明会資料
2009/3/24
田辺三菱製薬、試験データ改ざん 承認取り下げ、自主回収へ 田辺三菱製薬は3月24日、連結子会社のバイファと共同開発し、バイファが製造、田辺三菱製薬が販売している遺伝子組換え人血清アルブミン製剤で試験データの差し替えが行われていた事実が判明したため、製造販売承認を取下げ、自主回収を行うと発表した。
問題となったのは、献血による人の血液からつくられるアルブミン製剤の代替として開発された遺伝子組換え人血清アルブミン製剤「メドウェイ注5%」で、2007年10月に製造販売承認を取得、2008年5月より販売している。違反が確認されていない「メドウェイ注25%」についても、同一製造所で同一時期に実生産バリデーションが実施された製剤でもあり、自主回収の措置をとる。
昨年末にバイファ社より、承認事項一部変更承認申請について、試験データの差し替え行為に
関する報告があった。
製剤のアレルギー性を調べるためマウスを使った試験を実施。その際に、不純物が含まれる反応を示すデータが出たにもかからず、良好な試験データと差し替えたという。データの差し替えには品質管理責任者を含め計5人の職員がかかわっていたとみられている。
昨年5月に発売以降、約800人に使用されたが、健康被害の報告もないという。
厚生労働省は今後、立ち入り検査するなどし、厳正に対応するとしている。
バイファは1996年に遺伝子組換えアルブミンの開発・製造のため、ミドリ十字の100%子会社として設立され、2001年にニッショー(現ニプロ)が
49%出資した。
ディスポーザブル医療器具の大手で、人工腎臓用器具分野での強い基盤を持つニッショーの資本参加により、遺伝子組換えアルブミンの技術をいかした血漿代用剤以外の新規用途の開発や、新規血液浄化システムの開発、その他血漿蛋白製剤に関する遺伝子組換え技術の研究開発の推進
が図れ、将来におけるバイファの事業展開の可能性を一層広げることができるものと考えた。
毎日新聞
田辺三菱によると、バイファはこの製剤の承認に向けて05~07年に実施したラットの実験で、5回にわたりアレルギー抗体反応で一部陽性が出たデータを、すべて陰性のデータに差し替えた。また昨年5月に一部承認変更を申請した際は薬の安定性を保つ成分の含有量試験の数値が測定の不手際で正しく出なかったにもかかわらず、問題がないように装っていた。
捏造はそれぞれ別の職員が行い、職員は「上司の品質管理責任者の指示だった」と話しているという。
厚生労働省で会見した小峰副社長は「出荷時には改めてアレルギー検査をしており、品質に問題なく健康被害もない。生産体制の監視を徹底し、製造再開を目指したい」と話した。
厚生労働省の薬事・食品衛生審議会医薬品第二部会は7月25日開かれ、三菱ウェルファーマと製造子会社のバイファ(北海道千歳市)の2社がそれぞれ申請していた人血清アルブミン(遺伝子組換え)製剤の承認を了承した。 「アルブミンの喪失およびアルブミン合成低下による低アルブミン血症、出血性ショック」を効能・効果とする。人血漿由来ではなく、遺伝子組換えのアルブミン製剤を医薬品として承認するのは世界で初めて。海外では医薬品添加物用途で販売している国がある。
遺伝子組換えのため、人血漿由来による感染症のリスクはないが、製造に使用している「ピキア酵母」を原因とするアレルギーやアナフィラキシー様症状が臨床試験で見られている。そのため、ピキア酵母の抗体を調べる検査をし、原則、陰性患者に投与する。
承認条件ではないが、厚労省は市販後に1万人程度の患者を登録した市販後調査の実施を指示する方針。再審査機関は8年間。薬事分科会でも審議する。
販売名は、三菱ウェルファーマが「rHSA原液アルビースト注25%」「同5%」、バイファが「rHSA-原液バイファアルブレック注25%」「同5%」、両社は「アルブレック注」に1本化して販売する方針。
平成19年7月27日付「日刊薬業」より
従来のアルブミン製剤は人の血漿を原料としており、日本ではその半数を輸入に頼っていた。新発売された「メドウェイ」は、人血漿を用いず、遺伝子組換え技
術を使ってピキア酵母Pichia pastoris
で産生、精製した製剤で、高純度の人血清アルブミンの大量製造と供給が可能となった。また、製造工程でウイルスやプリオン等の感染性
物質混入の恐れある動物由来原料を使っていないため、感染リスクが少ないというメリットがある。
血清中のアルブミンは、血液の膠質浸透圧の80%を維持し、アルブミン1gで20mLの水分を保持している。アルブミン製剤では、こうしたアルブミンの
機能を期待して(1)出血性ショックなどに対して血漿膠質浸透圧を維持して循環血漿量を確保すること、(2)体腔内液や組織間液を血管内に移行させること
で治療抵抗性の重度の浮腫を治療すること――を目的に使用される。
アルブミンは血漿タンパクの中で、血管内に水を保持する働きが最大です。
この事により、私たちの血管中の血液量や体内での水分の量を調整する重要な働き
(血液の浸透圧 の維持)をしています。
血液中のアルブミンが低下すると、血管内の血液の量が少なくなったり、血管外(お腹や肺など)に
水が溜まったりします。
また、アルブミンは脂肪酸やホルモン、薬物など様々な物質と結合して、
必要な部位にこれらを運搬する働き(各種物質との結合と運搬)もしています。
アルブミンは、成人の場合アミノ酸を原料として肝臓で一日に6g~12g作られ、血液中に入ります。
またアルブミンは、体重1kgあたり4~5gが体内に貯蔵されています。
体重60kgの成人では、240~300gのアルブミンが存在することになります。
その約40%が血管内に、残り60%が血管外(細胞や組織間液中)に分布しています。
そして、血管内と血管外のアルブミンは相互に交換しながらバランスを保っており、
私たちの血漿中のアルブミン濃度は通常4.4~5%に保たれています。
14~18日間(半減期)体内で働いた後、アルブミンの多くは筋肉や皮膚において分解されます。
<「メドウェイ注」の製品概要>
人血清アルブミンは、医療用途としてアルブミンの喪失(熱傷、ネフローゼ症候群など)及びアルブミン合成低下(肝硬変症など)による低アルブミン血症、出血性ショックの治療に広く使用されています
これらヒト血漿由来製剤はヒトおよび動物由来ウイルス、プリオン等の感染性物質伝播の可能性は否定できず、遺伝子組換え体の開発が望まれていました
当社は、1981年から遺伝子組換え人血清アルブミンの研究を始め、血漿由来人血清アルブミンと、一次、二次、三次構造および物理的化学的性質に
ついて同等であることを確認し、生産技術(高い生産性、大量産生、高純度)を確立するとともに、非臨床試験および臨床試験を実施し、2007年10月に日
本において医療用医薬品(メドウェイ® )として初めての製造販売承認を取得いたしました
一方、アルブミンはワクチンや生物製剤の成分として、あるいは培地等、医薬品以外の用途で広く使用されています
当社では、rHSAをこれら医薬品以外の用途にも使用していただけるよう提供することが可能となりました
2011/6/17 田辺三菱/日本赤十字 日本赤十字社と田辺三菱製薬株式会社の血漿分画事業の統合の検討開始に関する基本合意について 本日、田辺三菱製薬株式会社(本社:大阪市中央区、代表取締役社長
土屋 裕弘)と日本赤十字社(本社:東京都港区、社長
近衛 忠煇)とは、田辺三菱製薬株式会社取締役会および、日本赤十字社理事会の承認の下、平成24年4月1日を目途として、田辺三菱製薬株式会社の完全子会社
で、血漿分画製剤の製造販売会社である株式会社 ベネシス と 日本赤十字社の血漿分画事業部門 との統合に向けた検討を開始することに合意しましたのでお知らせ
いたします。
日本赤十字社は、1952年の議員立法による日本赤十字社法による認可法人
1.事業統合の趣旨および目的 血液製剤の国内自給の確保と安定供給 が定められています。さらに、 世界保健機関 が加盟国に対して 国内自給の達成 を目的とした国家的、効率的かつ持続可能な血液事業を求め
るなど、国内自給達成が国際的な要請となっており、また、世界的な血液製剤の供給不足が生じた際に国民の生命身体を守るという安全保障の観点からも国内自
給達成が不可欠です。 営利を目的としない法人 とします。また、血漿分画製剤の国内必要原料を一括して処理
できる能力を持つ 大規模アルコール分画工場の新設 を行い、効率的な生産体制によって血液製剤の国内製造における中核的役割を担うことをめざします。
免疫グロブリン製剤は血液中に含まれる免疫グロブリンG(抗体)というタンパク質を高純度に精製・濃縮した製剤で、ハーバード大学の
Cohn 教授が開発した 低温エタノール分画法 (低温下でエタノー
ル濃度、pH等を調整することにより血漿から、グロブリン、アルブミンなどの血漿タンパク質を次々に分離させていく工業的な方法)で血漿中の免疫グロブリンGを精製濃縮することで製造される。
3.基本合意の骨子
ーーー
田辺製薬と合併前の三菱ウェルファーマは2002年10月に生物製剤製造部門を会社分割し、新設の「ベネシス」に承継させた。
2012/5/15 田辺三菱製薬
ファインケミカル事業の譲渡に関するお知らせ
田辺三菱製薬株式会社(本社:大阪市、代表取締役社長:土屋 裕弘)は、現在、自社が行うファインケミカル事業のうち、医薬品原薬の製造および販売に係る事業をエーピーアイ
コーポレーション に、食品に係る事業 をタイショー
テクノス に譲渡し、ファインケミカル事業から撤退することとしましたので、お知らせいたします。※1 に応える新しい医薬品を創製し、グローバルに提供する経営基盤を構築することで、世界の多くの患者さんのQOLの向上に貢献しつづけるため、「新薬創製力の強化」「新製品を軸とした国内事業の躍進」「海外事業拡大への基盤構築」「事業・構造改革の加速化」の4つの戦略課題を設定し、その確実な実行を図っているところです。(ご参考)
<株式会社エーピーアイ コーポレーション>
本 社 : 大阪市中央区平野町2-4-9
代 表 者 : 代表取締役社長 江村 泰一
資 本 金 : 40億円
売 上 高 : 29,284百万円(2011年3月期)
事業内容 : 医薬原体、医薬中間体、治験薬製造受託、R&D受託、化成品、試薬等の製造販売
従業員数 : 605名(2012年4月1日現在)
株 主 :
三菱化学株式会社(52.3%)、田辺三菱製薬株式会社(47.7%)
譲渡事業規模 : 医薬品原薬事業 約38億円(2011年3月期実績)
<株式会社タイショー テクノス>
本 社 : 東京都中央区日本橋富沢町10-18
代 表 者 : 代表取締役社長 伊藤 伸明
資 本 金 : 9,750万円
売 上 高 : 4,410百万円(2011年3月期)
事業内容 : 食品添加物(保存料、日持向上剤、品質改良剤、天然系着色料等)、工業用防腐・
従業員数 : 90名(2012年4月1日現在)
株 主 : 三井製糖株式会社(100%)
譲渡事業規模 : 食品事業 約25億円(2011年3月期実績)
2013/7/12 田辺三菱製薬
カナダ医薬品会社Medicago Inc.の株式取得(子会社化)に関するお知らせ
当社は、本日、Philip Morris International
Inc.(「PMI」)の子会社であるPhilip Morris Investments B.V.と共同で、Medicago
Inc.の全株式を、カナダ法上認められている友好的企業買収手法であるプラン・オブ・アレンジメント(Plan of
Arrangement*)により現金で取得することを、メディカゴ社取締役会と合意しましたので、お知らせいたします。持株比率60:40 )として運営していくことについて合意しています。
*Plan of
Arrangementとは、被買収会社が行うカナダ会社法上の買収手続きです。被買収会社の取締役会決議を経て、株主承認決議及び裁判所の承認、その他の条件を満たすことにより成立する買収の手法で、被買収企業が主導して手続きを行う友好的な企業買収手法です。
1.株式の取得の理由植物由来ウイルス様粒子(Virus Like Particle、「VLP」)技術を用いた新規ワクチンの研究開発に特化 したバイオ医薬品会社であり、遺伝子操作によって植物の細胞内にVLPを生成させ、効率的に抽出・精製する独自技術を有しています。また、VLPは、ウイルスと同様の外部構造を持つ一方、遺伝子情報を持たないため、ワクチンとしての高い免疫獲得効果が期待されることに加え、体内でウイルスの増殖がなく安全性に優れる有望なワクチン技術として注目されています。
*アンメット・メディカル・ニーズ:有効な治療法、医薬品がなく、未だに満たされない医療上のニーズ
2.当社とPhilip Morris Investments B.V.、メディカゴ社との関係について
4.異動する子会社(メディカゴ社)の概要
(1)
名称
Medicago Inc.
(2)
所在地
カナダ・ケベック市
(3)
代表者の役職・氏名
President
and CEO, Andrew J. Sheldon
(4)
事業内容
植物一過性発現VLP(Virus
Like Particles)ワクチンの研究開発
(5)
資本金
117百万カナダドル
(6)
設立年月日
1997年7月17日
(7)
大株主及び持株比率
Philip
Morris Investments B.V. (38.5%)
(8)
当社と当該会社
資本関係
当社は当該会社の発行済株式の6%を保有しています。なお、当社の関係者及び関係会社と当該会社の関係者及び関係会社の間には、特筆すべき資本関係はありません。
人的関係
当社と当該会社との間には、記載すべき人的関係はありません。また、当社の関係者及び関係会社と当該会社の関係者及び関係会社の間には、特筆すべき人的関係はありません。
取引関係
当社は、当該会社とワクチン共同研究契約を締結し、ロタウイルスVLPワクチンなどの共同研究を行っています。また、当社の親会社である株式会社三菱ケミカルホールディングスは、当該会社と植物を利用した次世代の蛋白質生産技術の開発に関する協業契約を締結し共同研究を行っています。
関連当事者へ
当該会社は、当社の関連当事者には該当しません。また、当該会社の関係者及び関係会社は、当社の関連当事者には該当しません。
(9)
当該会社の最近3年間の連結経営成績及び連結財務状態 (単位:千カナダドル)
決算期
2010年12月期
2011年12月期
2012年12月期
連結純資産
△5,158
37,754
6,925
連結総資産
21,313
80,394
49,334
1株当たり連結純資産
△0.04 CAD
0.15 CAD
0.03 CAD
連結売上高
109
187
5,540
連結営業利益
△17,558
△21,195
△32,654
連結経常利益
△17,558
△21,195
△32,654
連結当期純利益
△16,484
△20,992
△32,654
1株当たり連結当期純利益
△0.13 CAD
△0.12 CAD
△0.13 CAD
1株当たり配当金
-
-
-
(1)
異動前の所有株式数
15,385,000株
(2)
取得株式数
147,666,241株*
(3)
取得価額
メディカゴ社の普通株式 171百万カナダドル*
(4)
異動後の所有株式数
163,051,241株*
7.日程
(1)
取締役会決議
平成25年7月12日
(2)
株式取得契約締結
平成25年7月12日
(3)
株式譲渡手続完了
平成25年9月(予定)
名称
Philip
Morris International Inc.
本社所在地
米国・ニューヨーク州
代表者の役職・氏名
Chairman and CEO, André
Calantzopoulos
事業内容
米国以外におけるたばこの製造販売
売上高
77,393百万ドル(2012年度)
2016/9/6 田辺三菱製薬
サンファーマ製品に関する販売提携のお知らせ
---------
March 29, 2016
Sun Pharma to Buy Japanese Brands From
Novartis in $293 Million Deal
by a local marketing partner , which also would be responsible for
distribution.
2016/11/7 田辺三菱製薬
合弁会社設立に関する基本合意
一般財団法人 阪大微生物病研究会(BIKEN財団)と田辺三菱製薬は、BIKEN財団のワクチン製造事業を基盤とした合弁会社「株式会社BIKEN」を設立することに基本合意しましたので、お知らせいたします。
1.合弁会社設立の理由
(1)
名称
: 株式会社BIKEN
(2)
所在地 : 香川県観音寺市
(3)
事業内容 : ワクチンの製造
(4)
操業開始 : 2017年9月1日(予定)
(5)
資本金 : 未定
(6)
出資比率 : BIKEN財団 66.6%、田辺三菱製薬 33.4%
(7)
代表者 : 未定(BIKEN財団から派遣)
(8)
役員
: 取締役(BIKEN財団から4名、田辺三菱製薬から2名)
(9)
従業員
: 主としてBIKEN財団から生産関連職員(約500名)が出向
3. 基本合意の相手先
名称 一般財団法人阪大微生物病研究会
参考 2016/11/7 日東電工、世界初の革新的なワクチン投与のプラットフォーム構築
2017/3/28 田辺三菱製薬
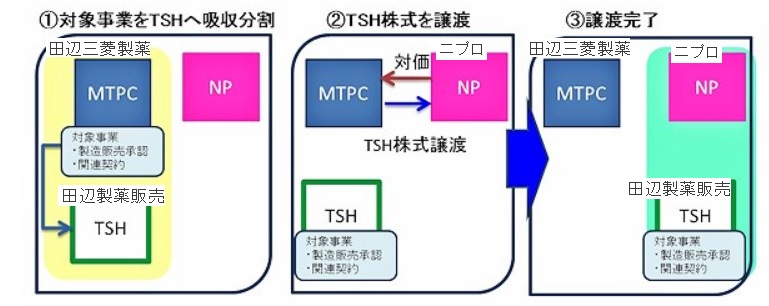
ジェネリック医薬品事業等の会社分割及び子会社の異動に関するお知らせ 当社は、本日開催の取締役会において、当社の保有するジェネリック医薬品事業及び長期収載品の一部 について、製造販売承認を含む販売権、製造委受託契約、共同開発契約ほかの関連契約、在庫、商標権、著作権並びに安全管理情報のすべてを田辺製薬販売に吸収分割により承継 させた上で、田辺製薬販売の全株式をニプロに譲渡 することを決議しましたので、下記のとおりお知らせします。
ジェネリック薬品 51 成分(2017 年6月収載予定品目 2
成分を含む)、長期収載品26成分、オーソライズド・ジェネリック薬品1成分
2019/7/24 田辺三菱製薬 約11億米ドル (約1,241億円)(一株あたり39.00米ドル)となる予定です。経口治療薬であるレボドパ および
カルビドパの液剤化 に世界で初めて成功し、それらを携帯ポンプにより24時間持続的に皮下注射 する 製剤です。これによりレボドパ
の血中濃度を一定にコントロールし、進行したパーキンソン病患者さんにおいて問題となる運動症状の改善が期待されています。
ドパミン(dopamine)は、中枢神経系に存在する神経伝達物質で、アドレナリン、ノルアドレナリンの前駆体でもある。ドパミン神経が減少 し筋固縮、振戦、無動などの運動症状が起こる。
パーキンソン病の病勢の進行を止める根本治療法はないものの、薬剤による対症療法が中心に行われている。ドパミン補充 のため、L-ドーパ含有製剤レボドパ (ドパゾール、ドパストン)およびレボドパ・カルビドパ水和物(ネオドパストン、メネシット)やペルゴリド(ペルマックス)、ブロモクリプチン(パーロデル)などのドパミン受容体刺激薬の錠剤が臨床使用されている。中でもドパミンの前駆体であるレボドパは、脳内でドパミンに変換され、PD症状の軽減に高い有用性を持つと評価されている。
当社は、中期経営計画16-20「Open Up the
Future」において、世界最大の医薬品市場である米国を中心に成長するため、自社販売による持続的成長基盤を早期に構築すること をめざしております。
その第一歩として、2017年8月に筋萎縮性側索硬化症(ALS)治療薬ラジカヴァの米国市場での販売開始を予定しております。
医薬品とデバイスを組み合わせた神経疾患領域のパイプラインを拡充することで、アンメット・メディカル・ニーズに応える
革新的な医薬品を創製し、患者さんに貢献してまいります。
NeuroDerm社の概要
名称 NeuroDerm Ltd.
所在地 Rehovot, Israel
事業内容
中枢神経系治療薬(パーキンソン病等)の研究開発
設立 2003年3月18日
大株主
Scopia Capital
Management LP and affiliates 16.6%
Robert Taub 12.3%
Uwe Wascher 11.4%
Shmuel Cabilly
10.0%
その他
ニューロダーム社の開発パイプライン
製品名 一般名 想定適応症 ステージ
ND0612
レボドパ/カルビドパ 持続皮下注投与ポンプ/パッチ製剤
パーキンソン病 (中等度/ 重症)
P3
ND0701
アポモルフィン 持続皮下注投与ポンプ
パーキンソン病 (重症)
P2
ND0801
ニコチン 及びオピプラモール 経皮剤
中枢神経 系疾患に 伴う認知障害
P2
-----------------
世界唯一の経皮吸収型ドパミンアゴニスト製剤「ニュープロ® パッチ」
世界で唯一の経皮吸収型 ドパミンアゴニスト
(ドパミン受容体に結合し刺激することにより作用を示す) 製剤として、1日1回の貼付で24時間安定した血中濃度を維持
特にパーキンソン病では、治療の満足度は未だ低く、早朝にかけて薬の効果が切れてしまい、目が覚めてもすぐに活動できないなど日常生活で困っている患者さんに、安定的な治療効果が期待される パーキンソン病およびレストレスレッグス症候群*2 の2つの効能・効果を同時取得
大塚製薬は、パーキンソン病およびレストレスレッグス症候群の治療薬として、「ニュープロパッチ」(一般名:ロチゴチン)の製造販売承認を2012年12月25日に取得しましたので、お知らせいたします。
経皮吸収型ドパミンアゴニスト製剤である「ニュープロパッチ」は、1日1回貼付するという簡便な投与方法で、薬剤が持続的に放出され、24時間血中濃度を一定に維持し、安定した効果が期待できます。
パーキンソン病は、国内に約14万人の患者さんがおり、4大症状(安静時振戦、固縮、無動、姿勢反射障害)*3 を主症状とする特定の脳神経細胞群が徐々に減少してしまう原因不明の病気です。
病状の進行したパーキンソン病の患者さんは、薬剤を服用していてもその効果が切れる時間があり、例えば早朝に動きにくい、夜間寝付けないなどの症状が現れ苦しんでいます。「ニュープロパッチ」は、1日1回の貼付で24時間を通してその効果を維持し、患者さんや介助者の負担を軽減することが期待されます。
レストレスレッグス症候群は、主に脚に「異常な感覚」が生じることによって、じっとしていられなくなる慢性疾患です。この訴えは、ふくらはぎがむずむずする、足の内部がかゆい、ほてる、痛いなど患者さんによって様々です。レストレスレッグス症候群の患者さんは、就寝前に最も症状が現れやすいことにより入眠障害に陥ることが知られています。また、日中の安静時にも脚の不快感が生じることがあります。「ニュープロパッチ」は、1日を通して患者さんの症状を抑えることが期待されます。
大塚製薬は、2002年に日本国内における「ニュープロパッチ」の独占的開発・販売権をベルギーのUCB社から取得し、開発 を行ってきました。海外ではNeupro® の製品名で、パーキンソン病で50カ国以上、レストレスレッグス症候群で30カ国以上の承認を得ています。
世界で唯一の経皮吸収型ドパミンアゴニスト製剤である「ニュープロパッチ」の承認により、大塚製薬はパーキンソン病およびレストレスレッグス症候群を抱える患者さんやそのご家族に貢献してまいります。
2019 年 11 月 18 日
三菱ケミカルホールディングス
田辺三菱製薬 に対する公開買付けの開始に関するお知らせ
三菱ケミカルホールディングス は、本日、 以下のとお り、 田辺三菱製薬 の普通株式 を金融商品取引法 に基づく公開買付けにより取得することを決 定 いたしまし たので、お知らせいた します。
1.買付け等の目的 等
(1)本公開買付けの概要
公開買付者は、 本日 現在、東京証券取引所市場第一部に上場している対象者の普通株式 316,320,069 株(所有割合 56.39 %)を所有しており、対象者 を連結子会社としております。
この度、公開買付者は、 本 日付で、会社法 第 370 条及び公開買付者定款第 27 条の規定に基づく取締役会決議に代わる書面決議 により、対象者普通株式の全て を取得し、対象者を公開買付者の完全子会社とすることを目的とした取引 の 一環として、本公開買付けを実 施することを決定いたしました。
以下 https://www.mitsubishichem-hd.co.jp/ir/pdf/00861/00955.pdf
2020/3/12
カナダ子会社における新型コロナウイルス感染症への取組みについて
田辺三菱製薬は、このたび、子会社であるメディカゴが、新型コロナウイルス感染症(COVID-19)に対応したウイルスの植物由来ウイルス様粒子(VLP)の作製に成功しましたので、お知らせいたします。
また、メディカゴはSARS-CoV-2(COVID-19の原因ウイルス)に対する抗体に関しても、自らの技術基盤を活用し、Laval University's
Infectious Disease Research Centre
(ラヴァル大学感染症研究センター:カナダ)と協力して研究を行っています。なお、本研究は、Canadian Institutes of Health
Research (CIHR:カナダ健康研究所)から一部資金提供を受けています。
---
2020/7/15 カナダ子会社における新型コロナウイルス感染症への取組みについて 田辺三菱製薬は、連結子会社であるMedicago(本社:カナダ
ケベック市)が、同社において開発を進めている新型コロナウイルス感染症(COVID-19)の予防をめざした植物由来のウイルス様粒子(VLP:*Virus Like
Particle:ウイルス様粒子)ワクチン(開発番号:MT-2766)に関する第1相臨床試験を開始した旨、発表したことをお知らせします。
田辺三菱製薬は2013年7月12日、Philip Morrisと共同で、カナダの医薬品会社 Medicago
Inc.の全株式を取得することで同社取締役会と合意したと発表した。
Medicagoは植物由来のウイルス様粒子(VLP:Virus Like
Particle)技術を用いた新規ワクチンの研究開発に特化したバイオ医薬品会社で、遺伝子操作によって植物の細胞内にVLPを生成させ、効率的に抽出・精製する独自技術を有している。
2013/7/19
田辺三菱製薬、カナダ医薬品会社Medicagoを子会社化
2016/2/26 田辺三菱製薬、タバコの葉からインフルエンザワクチン
MT-2766の第1相臨床試験では、単剤、GSK社のアジュバントまたはDynavax社のアジュバントを添加したワクチンを、3用量のグループにわけて、21日間隔で2回接種し、安全性と免疫原性を評価します。
The Phase I clinical trial is a
randomized, partially blinded study of 180 normal healthy subjects, male and
female aged 18-55, and will evaluate dosages of 3.75, 7.5 or 15 micrograms
of the recombinant Coronavirus Virus-Like Particle (CoVLP) vaccine candidate
alone or with an adjuvant in a prime-boost regimen. Medicago will be testing
its vaccine candidate with two adjuvants separately – GSK's proprietary
pandemic adjuvant technology and Dynavax's CpG 1018™. An adjuvant can be of
particular importance in a pandemic situation as it may boost the immune
response and reduce the amount of antigen required per dose, allowing more
vaccine doses to be produced and therefore contributing to protect the
greatest number of people.
当社グループは、社会の皆さまに一日も早くお届けできるよう、MT-2766の開発を着実に推進し、喫緊の社会課題であるCOVID-19の感染予防により一層貢献してまいります。
VLPワクチンについて ウイルスと同様の外部構造 を持ち、ワクチンとしての高い免疫獲得効果 (有効性)が期待されることに加え、遺伝子情報を持たないため体内でウイルスの増殖がなく、安全性 にも優れる有望なワクチン技術として注目されています。また、植物を使用したVLP製造技術により、短期間で大量生産が期待されます。
2 021 年 12 月 17 日
田辺三菱製薬
世界初の植物由来
COVID-19
ワクチン候補
MT-2766
カナダにおいて承認申請を実施
田辺三菱製薬 は、連結子会社であるメディカゴ社(本社︓カナダ
ケベック市 )が、 新型コロナウイルス感染症( COVID-19 )の予防をめざして開発している植物由来のウイルス様粒子 ( Virus
Like Particle 「 VLP 」)ワクチン(開発番号︓ MT-2766 )について、カナダにおいて 承認申請を行ったことを発表しましたので、お知らせします。
なお、 MT-2766
はグラクソスミスクライン社 のパンデミックアジュバントを併用しています。
MT-2766
は、カナダにおいて本年
4
月よりローリングサブミッション の審査が開始されており、 12
月
7 日に発表した第
2/3
相臨床試験の第
3
相パートでの良好な結果をもとに、申請資料の最終部分とし て第
3
相パートのデータを提出しました。メディカゴ社は
MT-2766
の
18
歳以上の健康成人に対する 審査と承認を求めています。カナダで承認されれば、ヒト用
VLP
ワクチンならびに
COVID-19
ワクチンと して世界初の植物由来ワクチンとなります。また、冷蔵(2 ~8 °C)での保存・流通が可能です。
日本においても、第
1/2
相臨床試験を本年
10
月から実施中であり、カナダ申請に用いたデータに日 本の臨床試験結果を加えて、来春の承認申請をめざしています。今後、 WHO 、米国、英国への承認 申請も行う予定です。また、今後、オミクロン株に対する
MT-2766
の抗体反応を確認する試験を実施 予定であり、その他、 MT-2766 、 mRNA
ワクチン、アデノウイルスベクターワクチン既接種者に対するブー スター試験を早期に実施できるよう検討を進めております。さらに小児への試験を予定しております。
当社グループは、中期経営計画
21-25
において、ワクチン領域を、中枢神経・免疫炎症領域となら ぶ重点領域と位置付け、ワクチン領域においても新しいモダリティの開発に取り組んでいます。すなわち、 新しいタイプのワクチンとなる植物由来
VLP
ワクチンという新たな選択肢を届けることで、世界の最重要 課題である感染症予防により一層貢献してまいります。
202 3
年
2
月
3
日
海外連結子会社
メディカゴ社の事業撤退に関するお知らせ
三菱ケミカルグループ は、当社グループの田辺三菱製薬 の連結子会社である
Medicago Inc. (所在地:カナダ・ケベック市、社長:多田
俊文、以下「メディカゴ社」)の全事業から撤 退することを決定しましたので、お知らせいたします。
1. 撤退の理由
メディカゴ社は、植物由来ウイルス様粒子 (Virus
Like
Particle 、以下「 VLP 」 ) 技術を用いた 新規ワクチンの研究開発に特化したカナダのバイオ医薬品会社であり、 2022
年2月には新型 コロナウイルス感染症の予防を適応として開発してきた
VLP
ワクチン「 COVIFENZ ® 」がカ ナダにおいて承認され、商用規模生産の移行に向け準備を進めてまいりました。
しかしながら、新型コロナウイルス感染症を取り巻く環境は大きく変化しており、現状の 新型コロナウイルスワクチンの世界的な需要及び市場環境と、商用規模生産の移行への同社 の課題を包括的に検討した結果、 COVIFENZ ® の商用化を断念するという結論に至りました。
また、メディカゴ社が保有する開発品の今後の事業化においても、更なる投資を継続的に行 うことが困難であると判断し、当該事業から撤退し清算を進めることを決定いたしました。
2.メディカゴ社の概要
(1)名称
Medicago Inc.
(2)所在地
カナダ・ケベック市
(3)代表者の役職・氏名
社長
多田
俊文
(4)事業内容
植物由来
VLP
技術を用いたワクチンの研究開発
(5)設立年月日
1997
年
7
月
17
日
(6)大株主及び持株比率
田辺三菱製薬
100%
田辺三菱製薬は2013年7月12日、Philip Morrisと共同で、カナダのMedicago
Inc.の全株式を取得することで同社取締役会と合意したと発表した。
2013/7/19
田辺三菱製薬、カナダ医薬品会社Medicagoを子会社化
報道では 現在の出資比率は田辺三菱が79%、Philip
Morrisが21%となっている。
2022年12月27日 Medicago Cuts Ties With Philip Morris 田辺三菱製薬
100%
Medicago Inc. severed ties
with cigarette maker Philip Morris International Inc after
the World Health Organization rejected the Canadian
company's Covid-19 vaccine, according to a tobacco control
body. Covifenz,
the world's first plant-based Covid vaccine, was jointly
developed by Medicago, which is owned by Mitsubishi
Chemical, Philip Morris and Glaxo. The Canadian government,
which provided $173 million in funding for its development,
has cleared it for use.
“Tobacco corporations,
vaccines and governments don't mix well and we applaud the
expulsion of Philip Morris from the Medicago collaboration,”
Les Hagen, the executive director of a not-for-profit
organization ASH Canada, said in a statement Monday.
Medicago's request for an
emergency-use listing was denied earlier this year by the
World Health Organization because of the links with tobacco
industry.
“We are relieved that
Canadian governments have washed their hands of this
unethical and embarrassing collaboration with a tobacco
giant,” Hagen said.
MedicagoはWHOに承認申請したが、WHOの関係者は2022年3月16日、Medicagoが開発した植物由来の新型コロナウイルスワクチンは、同社がタバコメーカーのPhilip
Morris からの出資(Philip
Morris 21%) を受けていることを理由に、WHOの緊急使用承認を「受けられない可能性が非常に高い」と発表した。
タバコや武器会社との提携に関するWHOの「非常に厳しい」ポリシーに抵触する恐れがあるため、緊急使用承認が一時停止されているという。
Medicago はWHOへの申請を取り下げたと報じられている。
3. 今後の予定
メディカゴ社の 活動を大幅に縮小し、事業撤退に向けた活動を進めます。 清算の手続き は、現地の法令に従って、順次実施する予定です。
4. 業績への影響
本件における業績への影響については現在精査中であり、今後、公表すべき事項が発生し た場合には速やかに公表い たします。